题目内容
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:
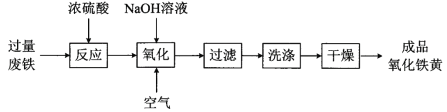
(1)氧化铁黄中铁元素的化合价为_____,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是______ (写离子方程式)。
(2)氧化过程生成氧化铁黄的化学方程式是_____________。
(3)上述流程中,检验“洗涤”是否完全的方法是________。
(4)氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是____。
【答案】+3 CO32-+H2O![]() HCO3-+OH- 4FeSO4+O2+8NaOH= FeOOH↓+4Na2SO4+2H2O 取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净 pH过低导致氧化铁黄部分溶于酸
HCO3-+OH- 4FeSO4+O2+8NaOH= FeOOH↓+4Na2SO4+2H2O 取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净 pH过低导致氧化铁黄部分溶于酸
【解析】
由流程可知,过量的废铁中加入浓硫酸,加热反应得到硫酸亚铁溶液,向硫酸亚铁溶液中加入氢氧化钠溶液,并通入空气,发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄。
(1)FeOOH中O元素为-2价,H元素为+1价,由化合价代数和为零可知Fe元素为+3价;废铁表面有防锈的油脂,碳酸钠在溶液中水解使溶液呈碱性,加热溶液碱性增强,油脂会在碳酸钠溶液中发生水解反应,达到清洗表面油污的目的,碳酸钠在溶液中水解的离子方程式为CO32-+H2O![]() HCO3-+OH-,故答案为:+3;CO32-+H2O
HCO3-+OH-,故答案为:+3;CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2)氧化过程为向硫酸亚铁溶液中加入氢氧化钠溶液,并通入空气,发生氧化还原反应生成氧化铁黄,反应的化学方程式为4FeSO4+O2+8NaOH=FeOOH↓+4Na2SO4+2H2O,故答案为:4FeSO4+O2+8NaOH=FeOOH↓+4Na2SO4+2H2O;
(3)由氧化过程的化学方程式可知,氧化铁黄表面附有可溶的硫酸钠,检查洗涤是否完全的标准是洗涤液中不含有硫酸根离子,则检验洗涤是否完全的方法是,取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净,故答案为:取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净;
(4)氧化时应控制pH的合理范围是保证产率最高,此时的pH范围为:3.5~4.0,若pH过小,氧化铁黄会溶解于酸导致产率降低,故答案为:pH过低导致氧化铁黄部分溶于酸。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796 g
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验Ⅰ | 将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN 溶液 | 溶液变红 |
注:经检验黑色固体为Ag
① 白色沉淀的化学式是_____________。
② 甲同学得出Ag+氧化了Fe2+的依据是_______________。
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
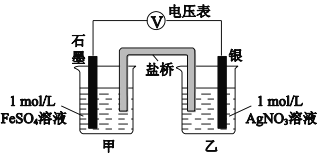
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是___________。
② b中电压表指针逆向偏移后,银为_________极(填“正”或“负”)。
③ 由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
序号 | 操作 | 现象 |
实验Ⅲ | 将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
实验Ⅳ | 将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
实验Ⅴ | 将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
① 实验Ⅲ___________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_____________。
② 用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:_____________。