题目内容
【题目】A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属” ,其基态原子外围电子占据两个能级且各能级电子数相等。请回答下列问题:
(1)A、B、C三种元素的第一电离能由小到大的顺序是_______(填元素符号)。
(2)D元素基态原子的核外电子排布式为____________________。
(3)白色晶体C3AB4中阴离子的空间立体构型是_______,中心原子的杂化方式是_____
(4)中学化学常见微粒中与A2B互为等电子体的分子有__________(任写一种即可)。
(5)已知D3+可形成配位数为6的配合物。现有组成皆为DCl3·6H2O的两种晶体,一种为绿色,另一种为紫色。为测定两种晶体的结构,分别取等量样品进行如下实验:
①将晶体配成水溶液,
②滴加足量AgNO3溶液,
③过滤出AgCl沉淀并进行洗涤、干燥、称量;
经实验测得产生的沉淀质量:绿色晶体是紫色晶体的2/3。依据测定结果可知绿色晶体的化学式为_______________,该晶体中含有的化学键有__________
a.离子键 b.极性键 c.非极性键 d.配位键
【答案】(1)Na<O<N(1分) (2)[Ar]3d24s2(1分) (3)正四面体(1分) sp3(1分)
(4)CO2或CS2(5)[Ti(H2O)5Cl]Cl2·H2O; abd
【解析】试题分析:A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2,则A原子核外电子排布式为1s22s22p3,A为氮元素;B的原子序数大于氮元素,则B原子核外电子排布式为1s22s22p4,B为氧元素;短周期主族元素中C元素的电负性最小,则C为Na元素;D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等,则D为Ti元素,
(1)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,结合金属性越强第一电离能越小,则第一电离能由大到小顺序是N>O>Na;
(2)Ti元素原子核外电子数为22,其基态原子的核外电子排布式是[Ar]3d24s2;
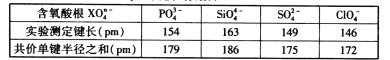
(3)该白色晶体为Na3NO4,NO43-离子中N原子价层电子对数=4+![]() =4,N原子没有孤对电子,故其为正四面体结构,N原子采取sp3杂化;
=4,N原子没有孤对电子,故其为正四面体结构,N原子采取sp3杂化;
(4)原子总数与价电子总数相同的微粒即为等电子体,利用代换法,可知与N2O互为等电子体的分子有CO2或CS2等;
(5)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2H2O,含有离子键、极性键、配位键。

【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
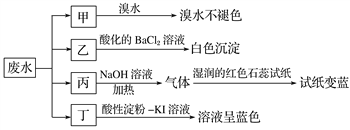
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为