题目内容
【题目】下表是元素周期表的一部分。
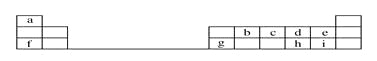
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
【答案】(1)第二周期第ⅣA族
(2)NH3 碱
(3)![]()
![]() F->Al3+
F->Al3+
(4)不稳定
(5)![]() 离子键和共价键
离子键和共价键
(6)SO2、SO3
【解析】试题分析:(1)元素b在元素周期表中的位置是第二周期第ⅣA族。
(2)元素H与N形成的4核10电子分子的化学式为NH3,其氨水溶液呈碱性。
(3)元素F-的结构示意图为![]() ,Al3+离子的结构示意图为
,Al3+离子的结构示意图为![]() ,电子层数相同,质子数越多半径越大,二者的离子半径大小顺序为F->Al3+。
,电子层数相同,质子数越多半径越大,二者的离子半径大小顺序为F->Al3+。
(4)F元素非金属性大于Cl,HCl比HF不稳定。
(5)氯气与氢氧化钠反应,可生成具有漂白作用的次氯酸钠,电子式为![]() ,次氯酸钠中所含的化学键类型为离子键和共价键。
,次氯酸钠中所含的化学键类型为离子键和共价键。
(6)元素O与S形成的化合物的化学式为SO2、SO3。

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目