题目内容
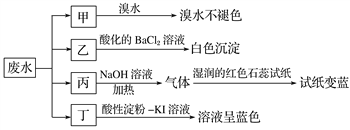
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
【答案】 NH4+ SO42- Cl- 6I-+8H++2NO3- =3I2+2NO+4H2O
【解析】试题分析:依据实验步骤分析判断,甲中加入溴水不褪色,证明不含还原性离子,推断不含SO32-;乙中加入酸化的氯化钡生成白色沉淀说明含有SO42-;丙中加入氢氧化钠溶液加热反应生成气体使湿润的红色石蕊试纸变蓝色,证明是氨气,说明原溶液中含有NH4+;丁中加入淀粉碘化钾溶液后溶液呈蓝色说明溶液中含有氧化性离子能氧化碘离子为单质碘;判断含有NO3-;
(1)根据以上分析可知离子X为NH4+,离子Y为SO42-;
(2)表中不能确定是否存在的阴离子是Cl-,能证明该阴离子是否存在的简单实验操作为,取少量溶液于试管中,加入稀硝酸,再加入硝酸银溶液生成白色沉淀证明氯离子的存在,若无白色沉淀产生,则不存在Cl-;
(3)废水试样中滴加淀粉一KI溶液所发生反应的离子方程式为6I-+2NO3-+8H+=3I2+2NO↑+4H2O;

 一本好题口算题卡系列答案
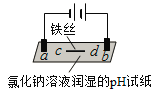
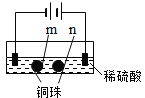
一本好题口算题卡系列答案【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜