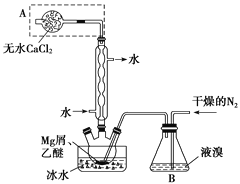
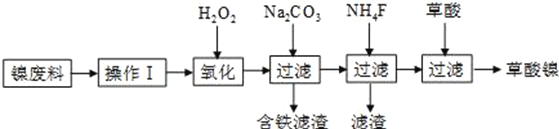
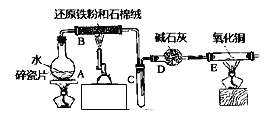
��Ŀ����
����Ŀ���й���ѧԺ�ٷ�����2017��3�·���������ר�⡷�����������ϸ������ij����ַ�������ͼ��ʾ��

(1)������ͼ��Ϣ���Կ�������������������Ⱦ�������ɻ�������ʻ��ɵ�_________,
a��SO2 b��NOx c��VOCs d�� NH3
(2)������������ʻ����ȾԴ֮һ����������������ϡȼ����ϵͳ��Ҫ����ԭ����ͼ��ʾ��д��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽ_______��

(3)SO2��������Ⱦ�����Ҫ�ɷ�֮һ����Ϊһ�ֻ�ѧ���ʻ��õ����ʣ����ܷ������ַ�Ӧ���밴���±���ʾ���Ӳ�ͬ�Ƕ�����SO2��ͬ��Ļ�ѧ���ʣ�����ѧ����ʽ�����±��С�
SO2�������� | ��ѧ����ʽ | |
������� | ���������� | ��SO2 +H2O |
��SO2 + CaO = CaSO3 | ||
��_______________________ | ||
SԪ�� ��̬ | SΪ+4�� | ��_______________________ |
�� SO2 + 2H2S = 3S + 2H2O | ||
(4)��ѧ�Ҿ����о������й��������ԣ�����Ҫԭ����ͼ��ʾ��

���ж�A�Ļ�ѧʽ��˵���ж����ɣ�______________________��
���𰸡�a 2NO+O2=2NO2 SO2+2NaOH��Na2SO3+H2O 2SO2+O2![]() 2SO3 SO42- ����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ����ߣ���+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ����
2SO3 SO42- ����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ����ߣ���+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ����
��������
��1����ͼ��֪SO2�����ɻ�������ʻ��ɵ���
��2��ϡȼ������NO��������������NO2��
��3��SO2���������������Ӧ�����κ�ˮ��SO2��SԪ��Ϊ+4�ۣ��м��+4��SԪ�ؼȿ��Եõ����ӷ�����ԭ��Ӧ��Ҳ����ʧȥ���ӷ���������Ӧ��
��4����Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ�SԪ�ػ��ϼ�������
��1��������ͼ��Ϣ���Կ�����������ʻ��ɵ���Ⱦ��NOx��VOCs��NH3��SO2�����ɻ�������ʻ��ɵģ���ѡa���ʴ�Ϊ��a��
��2��ϡȼ������NO��������������NO2����������Ҫ��Ӧ�ķ���ʽΪ2NO+O2=2NO2���ʴ�Ϊ��2NO+O2=2NO2��
��3��SO2���������������Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��SO2+2NaOH��Na2SO3+H2O��SO2��SԪ��Ϊ+4�ۣ��м��+4��SԪ�ؼȿ��Եõ����ӷ�����ԭ��Ӧ��Ҳ����ʧȥ���ӷ���������Ӧ������������Ӧ�ķ���ʽΪ��2SO2+O2![]() 2SO3���ʴ�Ϊ��SO2+2NaOH��Na2SO3+H2O��2SO2+O2
2SO3���ʴ�Ϊ��SO2+2NaOH��Na2SO3+H2O��2SO2+O2![]() 2SO3��
2SO3��
��4����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ�������SԪ�ش�+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ���ڣ�����A�Ļ�ѧʽΪSO42-���ʴ�Ϊ��SO42- ����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ����ߣ���+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ������

����Ŀ��������X����(�����)Y��Һ�У������ɳ��������ʵ��������X�����ʵ�����ϵ��ͼ��ʾ������ͼʾ�������( )
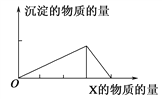
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D
����Ŀ����1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ_______________________________��NaH2PO2Ϊ__________������������������ʽ������������Һ��__________��������������������������������������
��2���±��г���ij�������ŷŵķ�ˮ�и��ɷֵĺ��������һ�����ֵ���й����ݣ�
������п��ˮˮ�� | ���������ˮ���һ�����ֵ | |
Zn2+Ũ��/��mg��L-1�� | ��800 | ��3.9 |
pH | 1��5 | 6��9 |
SO42-Ũ��/��mg��L-1�� | ��23000 | ��150 |
��ijһ���մ�����ķ�ˮpH��8�������£��÷�ˮ��Zn2+��Ũ��Ϊ__________mg��L-1(�����£�Ksp[Zn(OH)2]��1.2��10-17)��__________(����������������������)���һ�������