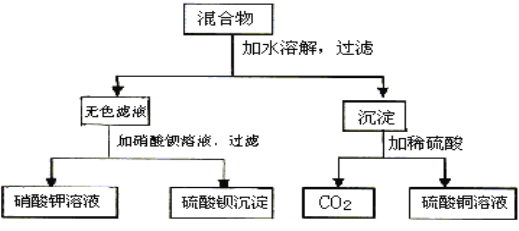
题目内容
【题目】(1)理论上任何一个自发的氧化还原反应均可以设计成原电池。根据氧化还原反应Fe+2Fe3+=3Fe2+设计的原电池如图所示,其中盐桥内装琼脂饱和KNO3溶液。
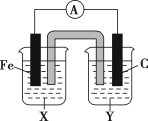
请回答下列问题:
①电解质溶液X是___;电解质溶液Y是___。
②写出两电极的电极反应式:铁电极:_;碳电极:__。
③外电路中的电子是从__电极流向__电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是__(填字母):A.K+ B.NO3-
(2)请将下列氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O设计成原电池,画出(1)中的装置图,并写出相应的电极反应式。
①原电池装置图:_______;
②正极:_________;
③负极:_________。
【答案】FeCl2(或FeSO4) FeCl3[或Fe2(SO4)3] Fe-2e-=Fe2+ 2Fe3++2e-=2Fe2+ 铁 碳 B 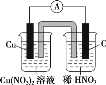 NO3-+3e-+4H+=NO↑+2H2O Cu-2e-=Cu2+
NO3-+3e-+4H+=NO↑+2H2O Cu-2e-=Cu2+
【解析】
(1)根据反应Fe+2Fe3+=3Fe2+分析,在反应中,Fe失电子,被氧化,Fe3+得电子,被还原;原电池中负极失电子发生氧化反应,Fe3+在正极上得电子被还原;外电路中的电子从负极流向正极,盐桥中的阴离子往负极移动,阳离子往正极移动,以此解答;
(2)根据原电池中负极失电子发生氧化反应,正极得电子发生还原反应,电解质一般为参与反应的离子所组成的化合物分析解答。
(1)①由反应Fe+2Fe3+=3Fe2+可知,在反应中,Fe被氧化,失电子,应为原电池的负极,Fe3+在正极上得电子被还原,C为正极,负极电解液X中应含有亚铁离子,正极反应为:Fe3++e-=Fe2+,因而Y为含Fe3+的电解质溶液,所以电解质X为:FeCl2(或FeSO4),电解质Y为:FeCl3[或Fe2(SO4)3];
②负极:Fe被氧化,失电子,电极反应为:Fe-2e-=Fe2+,Fe3+在正极上得电子被还原,电极反应为:2Fe3++2e-=2Fe2+;
③外电路电子由负极流向正极,所以外电路中电子是从铁电极流向碳电极;
④Fe是负极,因而向X中迁移的是阴离子,即为NO3,故答案选B;
(2)由氧化还原反应2Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知,Cu发生氧化反应,作负极,其电极反应式为Cu-2e-=Cu2+,则负极的电解质为Cu(NO3)2,正极应选用碳棒或其他惰性电极,其电极反应式为:2NO3+6e-+8H+=2NO↑+4H2O,则正极的电解质为稀HNO3,则该装置图为 。
。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:

实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快