题目内容
6.(Ⅰ)如图甲装置能组成原电池的是②④(填序号)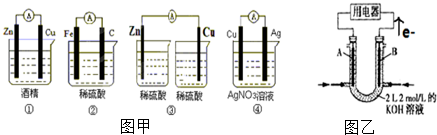
(Ⅱ)将CH4设计成燃料电池,装置如图乙所示(A、B为多孔碳棒)
①B(填A或B)处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-═CO32-+7H2O;
②当消耗甲烷的体积为11.2L(标准状况下)时,则导线中转移电子数为4NA,消耗KOH的物质的量为1mol.
分析 (Ⅰ)根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;
(Ⅱ)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据甲烷和转移电子、氢氧化钾之间的关系式计算.
解答 解:(Ⅰ)①酒精不导电,不能形成原电池,故①错误;
②铁为负极,C为正极,可形成原电池,故②正确;
③没有形成闭合回路,不能形成原电池,故③错误;
④Cu为负极,Ag为正极,可形成原电池,故④正确.
故答案为:②④;
(Ⅱ)①根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以B处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:B;CH4-8e-+10OH-═CO32-+7H2O;
②甲烷的物质的量为0.5mol,导线中转移电子的物质的量=0.5mol×8=4mol,电子数为4NA,根据CH4-8e-+10OH-═CO32-+7H2O知,消耗KOH的物质的量为甲烷物质的量的10倍,所以消耗氢氧化钾的物质的量是1mol,故答案为:4NA;1mol.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定氧化性强弱,根据方程式中各个物理量之间的关系式进行计算,题目难度不大.

练习册系列答案
相关题目
14.乙酸乙酯与乙醛(CH3CHO)的混合物中氢元素的质量分数为$\frac{1}{11}$,则氧元素的质量分数为( )
| A. | $\frac{10}{11}$ | B. | $\frac{4}{25}$ | C. | $\frac{4}{11}$ | D. | $\frac{4}{5}$ |
1.下列有关化学用语的表示方法中错误的是( )
| A. | CO2分子的结构式:O=C=O | |
| B. | S2-的结构示意图: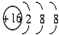 | |
| C. | R2+离子核外有a个电子,b个中子,R原子符号为:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的电子式: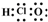 |
11.漂白粉可由Cl2通入消石灰中制备,漂白粉的有效成分是( )
| A. | Ca(OH)2 | B. | CaCl2 | C. | Ca(ClO)2 | D. | CaCO3 |
18.如图代表周期表中的几种短周期元素,下列说法中错误的是( )
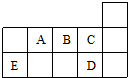

| A. | ED4分子中各原子均达8电子结构 | |
| B. | AD3和ED4两分子的中心原子均为sp3杂化 | |
| C. | A、B、C第一电离能的大小顺序为C>B>A | |
| D. | C、D气态氢化物稳定性强弱和沸点高低均为C>D |
15.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含电子数目为7NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 1mol苯乙烯(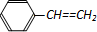 )中含有的C=C数为4NA )中含有的C=C数为4NA |
16.元素周期表的一部分,按要求完成各小题.(9分)
(1)化学性质最不活泼的元素Ar,非金属性最强的元素是F.(填元素符号)
(2)金属性最强的单质与水反应的化学方程式为:2K+2H2O═2KOH+H2↑①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH(写化学式).
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,写出盐B溶液与小苏打溶液反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
(2)金属性最强的单质与水反应的化学方程式为:2K+2H2O═2KOH+H2↑①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH(写化学式).
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,写出盐B溶液与小苏打溶液反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
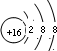 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为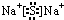 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.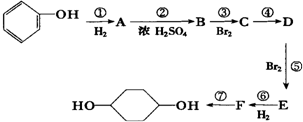 已知实验室由
已知实验室由 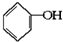 合成
合成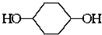 的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基) 、D
、D
 、
、