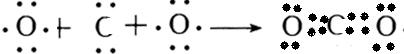题目内容
16.元素周期表的一部分,按要求完成各小题.(9分)| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
(2)金属性最强的单质与水反应的化学方程式为:2K+2H2O═2KOH+H2↑①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH(写化学式).
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,写出盐B溶液与小苏打溶液反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Al、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为F、⑩为Ar、⑪为Br.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱;
(2)上述元素中K的金属性最强,K与水反应生成氢氧化钾与氢气;金属性越强,最高价氧化物对应水化物的碱性越强;
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,则该元素为Al,盐A为铝盐、盐B为偏铝酸盐,偏铝酸盐与小苏打溶液反应生成氢氧化铝沉淀与碳酸盐,向该元素和⑧号元素组成的化合物为氯化铝,向氯化铝溶液缓缓滴加NaOH至过量,开始生成氢氧化铝沉淀,后氢氧化铝沉淀溶解.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Al、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为F、⑩为Ar、⑪为Br.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F的非金属性最强,
故答案为:Ar;F;
(2)上述元素中K的金属性最强,K与水反应生成氢氧化钾与氢气,反应方程式为:2K+2H2O═2KOH+H2↑;金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,
故答案为:2K+2H2O═2KOH+H2↑;NaOH;
(3)某元素的最高价氧化物的水化物既能与强酸反应生成盐A和水又能与强碱反应生成盐B与水,则该元素为Al,盐A为铝盐、盐B为偏铝酸盐,偏铝酸盐与小苏打溶液反应生成氢氧化铝沉淀与碳酸盐,负离子方程式为:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,向该元素和⑧号元素组成的化合物为氯化铝,向氯化铝溶液缓缓滴加NaOH至过量,开始生成氢氧化铝沉淀,后氢氧化铝沉淀溶解,现象为:随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
故答案为:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-;随着氢氧化钠的滴入,白色沉淀逐渐增加,当达到最多后又逐渐减少,最后完全消失,得到澄清溶液.
点评 本题考查元素周期表与元素周期律的应用,难度不大,注意对元素周期律的理解掌握.

| A. | 二氧化硫、二氧化氮和二氧化碳的任意排放都会导致酸雨 | |
| B. | Na2O可用于呼吸面具中作为氧气的来源 | |
| C. | 向煤中加入适量生石灰,可大大减少燃烧产物中SO2的量 | |
| D. | 稀双氧水可作医疗消毒剂,说明H2O2对人体无害 |
| A. | 肯定有CO2和SO2 | B. | 可能有HBr、CO2 | ||
| C. | 肯定没有HBr、H2S、HCl | D. | 以上结论均不正确 |



 .
. 如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:
如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空: 氯化铵
氯化铵 氢氧化钠
氢氧化钠
 ,二氧化碳
,二氧化碳