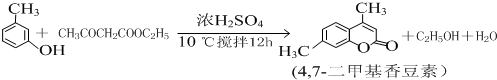
题目内容
2.下列有关电解质溶液的说法正确的是( )| A. | Na2SO3溶液加水稀释后,pH和KW均减小 | |
| B. | 0.1mol•L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 浓度分别为0.2mol•L-1和0.1mol•L-1的CH3COOH溶液中,c(H+)之比等于2:1 | |
| D. | 室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性 |
分析 A、KW只受温度的影响;
B、根据质子守恒来分析;
C、醋酸存在电离平衡,将其浓度稀释2倍,因电离平衡正向移动,c(H+)大于原来溶液中c(H+)的$\frac{1}{2}$;
D、NH3•H2O是弱电解质,不能完全电离.
解答 解:A、由于KW只受温度的影响,故加水稀释时,溶液的pH变小,但Kw不变,故A错误;
B、Na2CO3溶液中所有H+和OH-均全部来自于水,故根据质子守恒可有:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B正确;
C、在相同温度下,将0.2mol/L的CH3COOH溶液加水稀释至原体积的2倍,则浓度变为原来浓度的$\frac{1}{2}$,所以稀释后浓度为0.1mol/L,因稀释过程中醋酸电离平衡正向移动,因此0.1mol/L溶液中c(H+)大于原溶液中c(H+)的$\frac{1}{2}$,因此前者与后者的c(H+)比值小于2:1,故C错误;
D、NH3•H2O是弱电解质,不能完全电离,故将PH=12的氨水与PH=2的H2SO4溶液等体积混合后,氨水过量,故所得的溶液为硫酸铵和过量的氨水的混合溶液,溶液显碱性,故D错误.
故选B.
点评 本题考查了盐类水解的应用,应注意的是KW只受温度的影响,其它因素引起的平衡的移动,Kw均不变.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
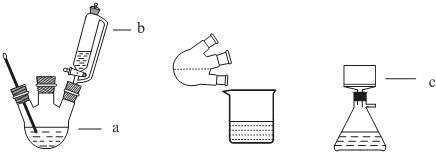
13.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A | B | C | D | |
| 实 验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体 混合物中回收I2 | 配制100mL 0.1000 mol•L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 | 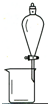 |  |  | 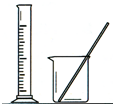 |
| A. | A | B. | B | C. | C | D. | D |
10.图所示有机物有除草功效.下列有关该有机物的说法错误的是( )
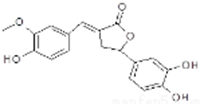

| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeC13发生显色反应,但不能和NaHCO3反应放出CO2 |
17.下列实验装置图所示的实验操作,正确的是( )
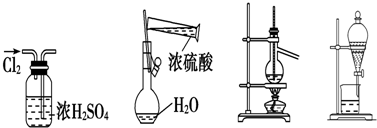

| A. | 干燥Cl2 | B. | 配制硫酸溶液 | C. | 蒸馏 | D. | 分液 |
14.下列反应的离子方程式表示正确的是( )
| A. | 将过量的铁丝投入稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| C. | NH4HCO3溶液与过量的NaOH溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 小苏打溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
11.在糕点食品的制作过程中,常需要加入在一定条件下能放出气体而使糕点疏松的膨化剂.下列物质中,适宜作糕点膨化剂的是( )
| A. | CaCO3 | B. | NH4HCO3 | C. | Na2CO3 | D. | NH4Cl |
12.把Ba(OH)2溶液滴入明矾溶液中,是SO42-全部转化为BaSO4沉淀,此时铝元素的主要存在形式是( )
| A. | 铝离子 | B. | 氢氧化铝 | ||
| C. | 四羟基合铝酸根离子 | D. | 铝离子和氢氧化铝 |