题目内容
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
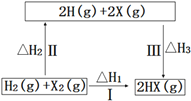
A.2H(g)+2X(g)=2HX(g) △H3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3
C.途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小
【答案】C
【解析】
A.原子形成化学键放热,焓变小于0,则![]() ,故A正确;
,故A正确;
B.由盖斯定律可知反应焓变只与起始物质和终了物质的能量有关,与变化途径无关,途径Ⅰ生成HX的反应热与途径无关,则![]() ,故B正确;
,故B正确;
C.因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl能量比HBr低,说明HCl比HBr稳定,故C错误;
D.Cl、Br、I的非金属性依次减弱,则稳定性:![]() ,所以途径Ⅱ吸收的热量依次减小,故D正确。
,所以途径Ⅱ吸收的热量依次减小,故D正确。
故选C。

【题目】汽车尾气中含有CO、NO等有害气体。
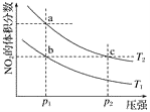
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。

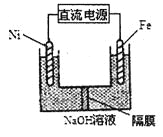
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)

①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。

(4)在容积固定的绝热容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变