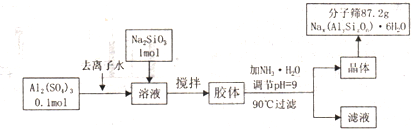
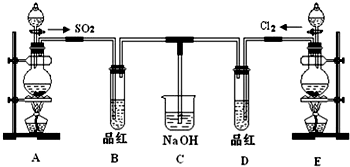
题目内容
9.以下是25℃时几种难溶电解质的溶解度:| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
分析 ①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液;
②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般将Fe2+先氧化成Fe3+,再调节溶液的pH=4,形成Fe(OH)3沉淀;
(1)Fe(OH)2的溶解度大于Fe(OH)3,上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为Fe(OH)3而除去;
(2)用氢氧化钠溶液,会引入新的杂质,沉淀表面含钠离子和氢氧根离子,需洗涤沉淀;
(3)根据题干信息结合难溶电解质的溶解度进行分析出反应物和生成物;
(4)A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染;
B.Fe(OH)2的溶解度大于Fe(OH)3,形成Fe(OH)2沉淀Fe2+沉淀不完全;
C.加入的氢氧化铜或碱式碳酸铜可以与H+反应,导致溶液的pH增大,当pH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀,且加入氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质;
D.pH=4的溶液中,Cu2+可以大量存在,而氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质;
E.在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀.
解答 解:(1)①中为了不引入其它杂质离子,应加氨水使Fe3+沉淀,生成Fe(OH)3,如用氢氧化钠溶液进行沉淀,则沉淀表面含钠离子和氢氧根离子,所以不用;
②根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+,;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般将Fe2+先氧化成Fe3+,再调节溶液的pH=4,形成Fe(OH)3沉淀;
故答案为:Fe(OH)3;
(2)①用氢氧化钠溶液,会引入新的杂质,沉淀表面含钠离子和氢氧根离子,为了不引入其它杂质离子,应加氨水使Fe3+沉淀,
故答案为:氨水;不会引入新的杂质;
(3)②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+:2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3;
故答案为:2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3;
(4)A.根据H2O2是绿色氧化剂,在氧化过程中被还原成水,不引进杂质、不产生污染,故A正确;
B.根据Fe(OH)2的溶解度大于Fe(OH)3,形成Fe(OH)2沉淀Fe2+沉淀不完全,故B错误;
C.原来溶液是酸性较强,加入氢氧化铜或碱式碳酸铜可以与H+反应.H+反应后,PH增大,当PH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀.而氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质,故C正确;
D.氢氧化铜或碱式碳酸铜与H+反应,H+反应后,PH增大,当PH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀,以Cu2+形式存在,而氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质,故D正确;
E.在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀,则Fe3+一定不能大量存在,故E正确;
故选:ACDE.
点评 本题主要考查了难溶物溶解平衡及其沉淀转化的实质,题目难度中等,明确铁的化合物的性质灵活运用题目信息是解题的关键,注意掌握难溶物溶解平衡及其影响.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 平均摩尔质量为31.8g/mol | B. | 质量仍为32g | ||
| C. | 密度仍与原气体密度相同 | D. | 对氢气的相对密度大 |
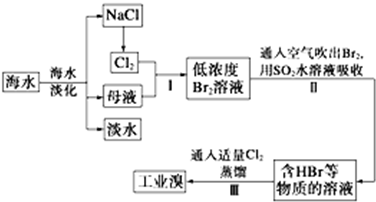
操作Ⅱ发生反应的离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
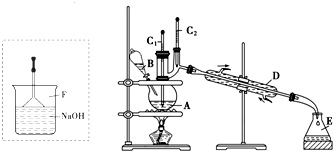
(2)溴苯是一种化工原料,可以用溴和苯反应合成.实验室合成溴苯的装置示意图如下:
下表为苯、溴和溴苯的相关数据:
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴.向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏.
①A的容积最适合的是c(填编号). a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据C2(填“C1”或“C2”)所显示的温度,其温度应为156℃.
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有Br2、HBr、C6H6(填化学式).
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应.
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液.如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应.该实验方案不合理(填“合理”或“不合理”),理由是溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应..
| A. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| C. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Na | |
| D. | 海水中含有溴元素,只需经过物理变化就可以得到溴单质 |