题目内容
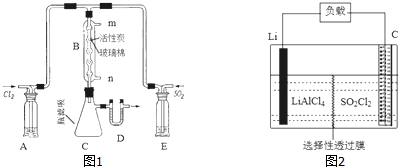
14.某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置.(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:分液漏斗上端玻璃塞没有取下来.
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.该反应中的还原剂是HCl(填化学式).
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是品红溶液褪色.
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B退色的品红溶液又恢复红色,D无明显现象.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色.请你分析产生该现象的原因Cl2+SO2+2H2O=2HCl+H2SO4(用化学方程式表示).
分析 (1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)氧化还原反应中存在元素化合价升高的物质为还原剂;
(3)SO2的漂白具有可逆性,次氯酸的漂白不可逆;
(4)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者发生反应Cl2+SO2+2H2O═2HCl+H2SO4.
解答 解:(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,
故答案为:分液漏斗上端玻璃塞没有取下来;
(2)在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,HCl中Cl元素化合价升高失电子,HCl作还原剂;
故答案为:HCl;
(3)SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色.氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色,次氯酸的漂白不可逆,加热时,不能恢复红色,
故答案为:①品红褪色;②褪色的品红又恢复成红色,无明显现象;
(4)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不褪色,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4.
点评 本题考查氯气和二氧化硫的漂白性质,题目难度不大,注意氯气和二氧化硫性质的不同,侧重于考查学生的实验探究能力和分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.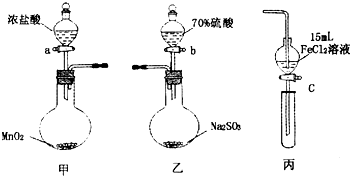 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
实验步骤:
Ⅰ在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接.
Ⅱ当丙装置中FeC12溶液变黄时,停止加热.
Ⅲ打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
Ⅳ在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止.
Ⅴ更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
回答下列问题:
(1)甲中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O.
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快.
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是Ⅰ、Ⅲ(用“Ⅰ”、“Ⅱ”、“Ⅲ”代号回答).
(5)若要用以上甲和丙装置证明氧化性为:Cl2>Fe3+>I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂FeI2、KSCN和一种溶剂CCl4.
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化.
③如果观察到丙中溶液下层(CCl4层)先由无色变为紫红色;后看到上层溶液由浅绿色变为红色则结论正确.
④停止通入Cl2.
 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).实验步骤:
Ⅰ在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接.
Ⅱ当丙装置中FeC12溶液变黄时,停止加热.
Ⅲ打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
Ⅳ在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止.
Ⅴ更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
回答下列问题:
(1)甲中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O.
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快.
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
(5)若要用以上甲和丙装置证明氧化性为:Cl2>Fe3+>I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂FeI2、KSCN和一种溶剂CCl4.
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化.
③如果观察到丙中溶液下层(CCl4层)先由无色变为紫红色;后看到上层溶液由浅绿色变为红色则结论正确.
④停止通入Cl2.
9.以下是25℃时几种难溶电解质的溶解度:
在无机化合物提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
19.下列微粒的半径比值大于1的是( )
| A. | Mg2+/Mg | B. | K+/S2- | C. | N/P | D. | Cl-/Cl |
6.如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )


| A. | 该元素的名称是铁 | B. | 该元素的原子序数为26 | ||
| C. | 该元素在地壳中的含量为55.85% | D. | 该元素的元素符号为Fe |
3.下列叙述正确的是( )
| A. | P4和NO2都是共价化合物 | |
| B. | 次氯酸的结构式为H-Cl-O | |
| C. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| D. | CCl4和NH4Cl都是以共价键结合的分子 |
4.下列说法中不正确的是( )
| A. | 糖类物质是绿色植物光合作用的产物,是动、植物所需能量的重要来源 | |
| B. | 淀粉和纤维素是天然高分子化合物 | |
| C. | 虽然纤维素水解的最终产物是葡萄糖,但由于人体内没有水解纤维素的酶,所以食物中的纤维素对人体没有任何作用 | |
| D. | 食物中的营养素主要包括糖类、油脂、蛋白质、维生素、无机盐和水 |