题目内容
9.在一容积为5L的密闭容器中放1mol 02放电产生下列反应:3O2═2O3,一段时间后,测得有20%的O2转化为O3,若温度和体积不变,对所得气体的下列说法不正确的是( )| A. | 平均摩尔质量为31.8g/mol | B. | 质量仍为32g | ||
| C. | 密度仍与原气体密度相同 | D. | 对氢气的相对密度大 |
分析 A.有20%的O2转化为O3,则参加反应的n(O2)=1mol×20%=0.2mol,剩余氧气物质的量=1mol×(1-20%)=0.8mol,根据氧气和臭氧关系得反应后n(O3)=$\frac{2}{3}$×0.2mol=$\frac{2}{15}$mol,反应后混合气体平均摩尔质量=$\frac{1mol×32g/mol}{0.8mol+\frac{2}{15}mol}$;
B.根据质量守恒定律确定混合气体质量;
C.气体密度ρ=$\frac{m}{V}$;
D.标况下混合气体体积=(0.8mol+$\frac{2}{15}$mol)×22.4L/mol≈21L,该条件下气体体积为5L,所以该条件下气体密度较大.
解答 解:A.有20%的O2转化为O3,则参加反应的n(O2)=1mol×20%=0.2mol,剩余氧气物质的量=1mol×(1-20%)=0.8mol,根据氧气和臭氧关系得反应后n(O3)=$\frac{2}{3}$×0.2mol=$\frac{2}{15}$mol,反应后混合气体平均摩尔质量=$\frac{1mol×32g/mol}{0.8mol+\frac{2}{15}mol}$=34.29g/mol,故A错误;
B.反应前氧气质量=1mol×32g/mol=32g,根据质量守恒定律确定混合气体质量为32g,故B正确;
C.气体密度ρ=$\frac{m}{V}$,气体质量不变、体积不变,所以密度不变,故C正确;
D.标况下混合气体体积=(0.8mol+$\frac{2}{15}$mol)×22.4L/mol≈21L,该条件下气体体积为5L,所以该条件下气体密度较大,故D正确;
故选A.
点评 本题考查根据方程式计算,为高频考点,侧重考查质量守恒定律、物质的量有关计算等知识点,易错选项是C,注意该反应过程中容器体积不变,为易错点.

| A. | 六氟合铝酸钠:Na3[AlF6] | B. | 氢氧化二氨合银:[Ag(NH3)2]OH | ||
| C. | 六氟合铁酸钾:K3[FeF6] | D. | 十二水硫酸铝钾:KAl(SO4)2•12H2O |
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
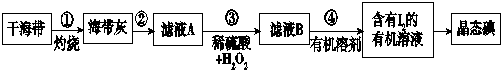
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
 图中线段分别是A,B,C是在2L容器中的物质的量随时间的变化曲线.由图中数据分析:
图中线段分别是A,B,C是在2L容器中的物质的量随时间的变化曲线.由图中数据分析: