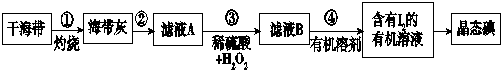
题目内容
10.钠是很活泼的金属.在空气中燃烧的产物是Na2O2,Na2O的制取可以通过如下反应完成:Na+NaN03$\stackrel{△}{→}$ Na2O+N2↑(未配平).请回答下列问题:上述反应的氧化剂是NaNO3(写化学式).制取Na2O时,若金属钠与NaNO3按质量比23:17投料,充分反应后收集到的气体体积为1.12m3(标准状况).则制得的Na2O的质量为18.6kg.分析 钠元素化合价由0价升高到+1,所以金属钠是还原剂,氮元素化合价由+5降低到0价,NaNO3是氧化剂,根据得失电子守恒,反应方程式为2NaNO3+10Na$\frac{\underline{\;\;△\;\;}}{\;}$6Na2O+N2↑,根据方程式计算.
解答 解:钠元素化合价由0价升高到+1,所以金属钠是还原剂,氮元素化合价由+5降低到0价,NaNO3是氧化剂,根据得失电子守恒,反应方程式为2NaNO3+10Na$\frac{\underline{\;\;△\;\;}}{\;}$6Na2O+N2↑,若金属钠与NaNO3按质量比23:17投料则物质的量之比为$\frac{23}{23}$:$\frac{17}{85}$=5:1,充分反应后收集到的气体体积为1.12m3(标准状况)即$\frac{1.12×10{\;}^{3}L}{22.4L/mol}$=50mol,则制得的Na2O的质量为50mol×6×62=18.6Kg,故答案为:NaNO3 ;18.6.
点评 本题考查学生氧化还原反应中的概念和方程式的计算等知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
5.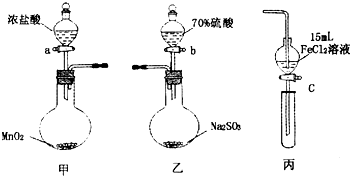 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
实验步骤:
Ⅰ在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接.
Ⅱ当丙装置中FeC12溶液变黄时,停止加热.
Ⅲ打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
Ⅳ在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止.
Ⅴ更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
回答下列问题:
(1)甲中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O.
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快.
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是Ⅰ、Ⅲ(用“Ⅰ”、“Ⅱ”、“Ⅲ”代号回答).
(5)若要用以上甲和丙装置证明氧化性为:Cl2>Fe3+>I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂FeI2、KSCN和一种溶剂CCl4.
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化.
③如果观察到丙中溶液下层(CCl4层)先由无色变为紫红色;后看到上层溶液由浅绿色变为红色则结论正确.
④停止通入Cl2.
 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).实验步骤:
Ⅰ在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接.
Ⅱ当丙装置中FeC12溶液变黄时,停止加热.
Ⅲ打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
Ⅳ在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止.
Ⅴ更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
回答下列问题:
(1)甲中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O.
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快.
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
(5)若要用以上甲和丙装置证明氧化性为:Cl2>Fe3+>I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂FeI2、KSCN和一种溶剂CCl4.
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化.
③如果观察到丙中溶液下层(CCl4层)先由无色变为紫红色;后看到上层溶液由浅绿色变为红色则结论正确.
④停止通入Cl2.
12.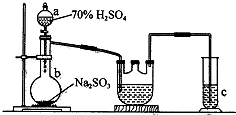 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
(l)a装置的名称:分液漏斗;c装置的目的吸收二氧化硫,防止污染空气.
(2)b中制SO2的化学方程式为-_Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑_;控制b中反应速率的方法是通过分液漏斗颈部活塞控制低价硫酸的快慢.
(3)当三颈烧瓶中溶液接近中性时停止通人气体,蒸发得到固体产品.取1.0g固体产品溶于5mL水中,加入1mL的银氨溶液,振荡,水浴10s出现银镶.
甲同学得出结论:10s时Na2S2O4银氨溶液反应形成银镜.
乙同学认为上述实验不能说甲的结论一定成立,其依据可能是因为HCOONa过量,分离出的晶体所含杂质HCOONa具有还原性也能发生银镜反应.
针对甲、乙同学的分歧,丙同学取该实验所得固体设计如下实验方案,请你帮助完成:
 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O(l)a装置的名称:分液漏斗;c装置的目的吸收二氧化硫,防止污染空气.
(2)b中制SO2的化学方程式为-_Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑_;控制b中反应速率的方法是通过分液漏斗颈部活塞控制低价硫酸的快慢.
(3)当三颈烧瓶中溶液接近中性时停止通人气体,蒸发得到固体产品.取1.0g固体产品溶于5mL水中,加入1mL的银氨溶液,振荡,水浴10s出现银镶.
甲同学得出结论:10s时Na2S2O4银氨溶液反应形成银镜.
乙同学认为上述实验不能说甲的结论一定成立,其依据可能是因为HCOONa过量,分离出的晶体所含杂质HCOONa具有还原性也能发生银镜反应.
针对甲、乙同学的分歧,丙同学取该实验所得固体设计如下实验方案,请你帮助完成:
| 实验步骤 | 现象及结论 |
| 步骤Ⅰ:对三颈烧瓶分离出的产品进行重结晶得到纯净的Na2S2O4(仅需说明方法) | |
| 步骤Ⅱ:取0.1g步骤Ⅰ的产品溶于5mL银氨溶液,振荡,水浴加热10s,观察现象 | 若10S出现银镜,则甲的结论正确(或Na2S2O4具有还原性),反之则乙正确 |
9.以下是25℃时几种难溶电解质的溶解度:
在无机化合物提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.