题目内容
1.全世界铜的年产量约为8×106吨,工业上由辉铜矿(主要成分是Cu2S)生产铜的主要反应为:Cu2S+O2═2Cu+SO2(1)若采用这种方法冶炼铜,每年需要消耗Cu2S的质量为多少?
(2)每年产生二氧化硫的体积(STP)为多少?
(3)你认为用什么办法可有效的缓解因此而造成的酸雨问题?
分析 (1)结合反应及质量之比等于相对分子质量之比计算;
(2)结合反应计算二氧化硫的物质的量,结合V=nVm计算体积;
(3)减少二氧化硫的排放可减少酸雨.
解答 解:(1)设需要消耗的Cu2S为x,则:
Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2
160 128
x 8×106t
x=$\frac{160×8×1{0}^{6}}{128}$=1×107t,
答:需要消耗Cu2S的质量为1×107t;
(2)8×106t Cu 的物质的量为$\frac{8×1{0}^{12}g}{64g/mol}$=1.25×1011mol,
由方程式可知,n(SO2)=$\frac{1}{2}$×1.25×1011mol,故V(SO2)=$\frac{1}{2}$×1.25×1011mol×22.4L/mol=1.4×1012L,
答:每年产生二氧化硫的体积(STP)为1.4×1012L;
(3)减少二氧化硫的排放可减少酸雨,则废气经处理后排放或开发其他炼铜的方法等可有效的缓解因此而造成的酸雨问题,
答:废气经处理后排放或开发其他炼铜的方法等可有效的缓解因此而造成的酸雨问题.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应中物质的量关系、物质的量的相关计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
12.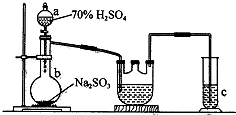 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
(l)a装置的名称:分液漏斗;c装置的目的吸收二氧化硫,防止污染空气.
(2)b中制SO2的化学方程式为-_Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑_;控制b中反应速率的方法是通过分液漏斗颈部活塞控制低价硫酸的快慢.
(3)当三颈烧瓶中溶液接近中性时停止通人气体,蒸发得到固体产品.取1.0g固体产品溶于5mL水中,加入1mL的银氨溶液,振荡,水浴10s出现银镶.
甲同学得出结论:10s时Na2S2O4银氨溶液反应形成银镜.
乙同学认为上述实验不能说甲的结论一定成立,其依据可能是因为HCOONa过量,分离出的晶体所含杂质HCOONa具有还原性也能发生银镜反应.
针对甲、乙同学的分歧,丙同学取该实验所得固体设计如下实验方案,请你帮助完成:
 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O(l)a装置的名称:分液漏斗;c装置的目的吸收二氧化硫,防止污染空气.
(2)b中制SO2的化学方程式为-_Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑_;控制b中反应速率的方法是通过分液漏斗颈部活塞控制低价硫酸的快慢.
(3)当三颈烧瓶中溶液接近中性时停止通人气体,蒸发得到固体产品.取1.0g固体产品溶于5mL水中,加入1mL的银氨溶液,振荡,水浴10s出现银镶.
甲同学得出结论:10s时Na2S2O4银氨溶液反应形成银镜.
乙同学认为上述实验不能说甲的结论一定成立,其依据可能是因为HCOONa过量,分离出的晶体所含杂质HCOONa具有还原性也能发生银镜反应.
针对甲、乙同学的分歧,丙同学取该实验所得固体设计如下实验方案,请你帮助完成:
| 实验步骤 | 现象及结论 |
| 步骤Ⅰ:对三颈烧瓶分离出的产品进行重结晶得到纯净的Na2S2O4(仅需说明方法) | |
| 步骤Ⅱ:取0.1g步骤Ⅰ的产品溶于5mL银氨溶液,振荡,水浴加热10s,观察现象 | 若10S出现银镜,则甲的结论正确(或Na2S2O4具有还原性),反之则乙正确 |
9.以下是25℃时几种难溶电解质的溶解度:
在无机化合物提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将
Fe2+氧化Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质_.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
16.属于铝热反应的是( )
| A. | Al+HCl | B. | Al+Fe2O3 | C. | Al+NaOH | D. | Al+O2 |
6.如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )


| A. | 该元素的名称是铁 | B. | 该元素的原子序数为26 | ||
| C. | 该元素在地壳中的含量为55.85% | D. | 该元素的元素符号为Fe |
13.下列说法正确的是( )
| A. | 13C和15N的质子数相差2 | B. | 18O的原子核内中子数为8 | ||
| C. | 12C和13C互为同位素 | D. | 1H2O和 2H2O互为同素异形体 |