题目内容
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备FeCO3的流程如下:
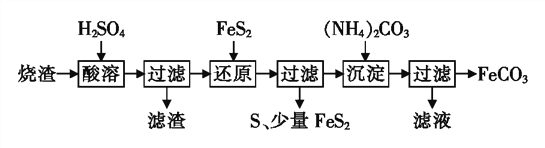
(1)“酸溶”时加快反应速率的方法有______(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O![]() 15Fe2++2S
15Fe2++2S![]() +16H+,则另一个反应的离子方程式为_________。
+16H+,则另一个反应的离子方程式为_________。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是______________________。
(3)①“沉淀”时,需要控制温度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗涤,检验沉淀已洗净的方法是______________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_______(填化学式)。
(5)写出在空气中煅烧FeCO3制备高纯氧化铁的化学方程式:_________________。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,则Fe2O3的质量为____kg。
【答案】 加热(或增加硫酸的浓度、将烧渣粉碎、搅拌等) FeS2+2Fe3+ = 3Fe2++2S↓ 取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全 防止碳酸铵分解,减小亚铁离子的水解程度 取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明沉淀已洗涤干净,反之,则说明没洗涤干净 O2、H2O 4FeCO3+O2![]() 2Fe2O3+4CO2 14.4
2Fe2O3+4CO2 14.4
【解析】(1)“酸溶”时,可以加快反应速率的方法有多种,如加热(或增加硫酸的浓度、将烧渣粉碎、搅拌等)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O![]() 15Fe2++2S
15Fe2++2S![]() +16H+,则另一个反应的离子方程式为FeS2+2Fe3+ = 3Fe2++2S↓。
+16H+,则另一个反应的离子方程式为FeS2+2Fe3+ = 3Fe2++2S↓。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全。
(3)①碳酸铵受热易分解,,温度升高亚铁离子的水解程度会增大,所以,“沉淀”时,需要控制温度在35 ℃以下,其可能原因是防止碳酸铵分解,减小亚铁离子的水解程度。
②FeCO3是从硫酸铵溶液中分离出来的,洗涤是否干净可以通过检验硫酸根离子来证明,所以检验沉淀已洗净的方法是:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明沉淀已洗涤干净,反之,则说明没洗涤干净。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,说明FeCO3可以被空气中的氧气氧化并发生水解生成氢氧化铁和二氧化碳,所以与FeCO3反应的物质为O2、H2O。
(5)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为4FeCO3+O2![]() 2Fe2O3+4CO2。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,设其中Fe2O3的质量为x,根据化学反应前后铁元素质量不变可得:
2Fe2O3+4CO2。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,设其中Fe2O3的质量为x,根据化学反应前后铁元素质量不变可得:![]() ×100%×x+
×100%×x+![]() ×100%×(15.84 kg-x)=
×100%×(15.84 kg-x)=![]() ×100%×23.2 kg,解之得x=14.4 kg。
×100%×23.2 kg,解之得x=14.4 kg。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案