题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________(用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________(用离子方程式表示)。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________;②____________________________;③____________________________。
(2)溶液中共有__________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________,浓度为0.002mol·L-1的是____________。
(4)__________和__________两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO![]() 的电离程度_________(填“大于”、“小于”或“等于”)HSO
的电离程度_________(填“大于”、“小于”或“等于”)HSO![]() 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________。
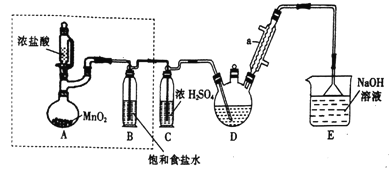
III、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾为FeSO4·7H2O,反应(I)中FeSO4与Cr2O72﹣ 的物质的量之比为_________.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______.(Ksp[Cr(OH)3]=6.0×10﹣31)
【答案】 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3++3HCO3-===Al(OH)3+3CO2↑ CH3COO-+H2O
Al(OH)3(胶体)+3H+ Al3++3HCO3-===Al(OH)3+3CO2↑ CH3COO-+H2O![]() CH3COOH+OH- CH3COOH
CH3COOH+OH- CH3COOH![]() CH3COO-+H+ H2O
CH3COO-+H+ H2O![]() H++OH- 7 Na+ Cl- CH3COOH CH3COO- 大于 c(H2O)>c(Na+)>c(HSO
H++OH- 7 Na+ Cl- CH3COOH CH3COO- 大于 c(H2O)>c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)>c(H2SO3) 6:1 6
)>c(OH-)>c(H2SO3) 6:1 6
【解析】I、明矾常作净水剂,其净水的原理是明矾溶于水电离出的铝离子发生水解,生成氢氧化铝胶体,能吸附水中的悬浮颗粒并沉降下来使水变澄清,用离子方程式表示为Al3++3H2O![]() Al(OH)3(胶体)+3H+;硫酸铝常作泡沫灭火器原料之一,其原理是铝离子与碳酸氢根离子发生了双水解反应,生成了大量的含有二氧化碳的泡沫,其离子方程式为Al3++3HCO3-===Al(OH)3+3CO2↑。
Al(OH)3(胶体)+3H+;硫酸铝常作泡沫灭火器原料之一,其原理是铝离子与碳酸氢根离子发生了双水解反应,生成了大量的含有二氧化碳的泡沫,其离子方程式为Al3++3HCO3-===Al(OH)3+3CO2↑。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液后,两者发生反应,生成0.002 mol CH3COOH、0.002molNaCl,余0.008mol CH3COONa.
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①CH3COO-+H2O![]() CH3COOH+OH-;②CH3COOH
CH3COOH+OH-;②CH3COOH![]() CH3COO-+H+;③H2O
CH3COO-+H+;③H2O![]() H++OH-。
H++OH-。
(2)溶液中共有CH3COO-、H2O、CH3COOH、OH-、H+、Cl-、Na+等7种不同的粒子。
(3)在这些粒子中,Cl-、Na+不参加离子反应,所以浓度为0.01mol·L-1的是Na+、浓度为0.002mol·L-1的是Cl-。
(4)由物料守恒知,CH3COOH和CH3COO-两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红,说明溶液呈酸性,进一步说明亚硫酸氢根离子在水溶液中的电离程度大于其水解程度。①该溶液中HSO![]() 的电离程度大于HSO
的电离程度大于HSO![]() 的水解程度。②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为c(H2O)>c(Na+)>c(HSO
的水解程度。②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为c(H2O)>c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)>c(H2SO3),水最多,其次是不水解的钠离子;HSO3-不论电离还是水解,其变化的程度都较小,所以HSO3-排第三位;不仅HSO3-电离出氢离子,水也电离出氢离子,所以H+排第四位;亚硫酸根只由HSO3-电离产生,所以排第五位;氢氧根既由水电离产生,也由HSO3-水解产生,所以排第六位;亚硫酸分子只由HSO3-水解产生,所以其浓度最小。
)>c(OH-)>c(H2SO3),水最多,其次是不水解的钠离子;HSO3-不论电离还是水解,其变化的程度都较小,所以HSO3-排第三位;不仅HSO3-电离出氢离子,水也电离出氢离子,所以H+排第四位;亚硫酸根只由HSO3-电离产生,所以排第五位;氢氧根既由水电离产生,也由HSO3-水解产生,所以排第六位;亚硫酸分子只由HSO3-水解产生,所以其浓度最小。
III、(1)反应(I)中,绿矾中的+2价铁化合价升高到+3价,而Cr2O72﹣中铬元素的化合价由+6下降到+3,由电子转移守恒可知,FeSO4与Cr2O72﹣ 的物质的量之比为6:1.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的c(OH-)=![]() mol/L,则c(H+)=
mol/L,则c(H+)=![]() mol/L,所以处理后的废水的pH=6.
mol/L,所以处理后的废水的pH=6.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
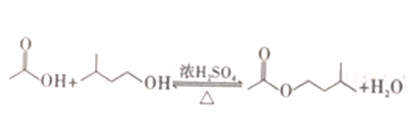
小学生10分钟应用题系列答案【题目】工业上用过量的乙酸和异成醇制备乙酸异戊酯,原理(如图所示) 和有关数据如下:
物质 | 相对分子质量 | 密度/(g·cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解度 |
异戊醇 | 88 | 0.8123 | -117 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 17 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | -78 | 142 | 难溶 |
下列说法正确的是
A. 常温下,可用过滤的方法分离乙酸异戊酯和水溶液
B. 反应中,加入过量的乙酸的主要目的是加快该反应的反应速率
C. 为了除去产物中混有的乙酸,可以向混合物中加入足量饱和Na2CO3溶液,充分振荡后静置、分液
D. 为了除去产物中混有的异戊醇,应选择如图所示装置中的c装置