��Ŀ����
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
(1)��ԭ������������˳��(ϡ���������)������˵����ȷ����_______��
a.���ʵ��۵㽵��
b.ԭ�Ӱ뾶�ͼ����Ӱ뾶����С
c.Ԫ�صĽ����Լ������ǽ�������ǿ
d.�������Ӧ��ˮ������Լ�����������ǿ
(2)�����������ļ���������_______�����ȶ��ԣ�H2O____H2S(��>��<��=)��
(3)д��SiCl4�ĵ���ʽ��________��
(4)��֪������M�ɵ������ڵ���������Ԫ�ذ�ԭ�Ӹ�����1:1��ɣ����ȶ�����ˮ��Ӧ����̸��ɫ����A��������ɫ�д�������ζ����B��C����Ӧ���ʵ�ת����ϵ��ͼ��

����֪M��Ħ������Ϊ135g/mol��д��M�Ļ�ѧʽ_____��
����ѡһ�ֺ��ʵ�������Y��д��C��Ũ��Һ��Y��Ӧ����D�����ӷ�Ӧ����ʽ_______��
��M�е�һ��Ԫ�ؿ��γɻ�����KXO3��������ʵ������O2�������Ӵ�����400��ʱKXO3�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��____________��
���𰸡� c Na+(��������) > 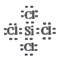 S2Cl2 MnO2+2Cl-+4H+=Mn2++Cl2��+2H2O(��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����������Ҳ����) 4KCIO3
S2Cl2 MnO2+2Cl-+4H+=Mn2++Cl2��+2H2O(��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����������Ҳ����) 4KCIO3![]() KCl+3KClO4
KCl+3KClO4
����������1���ᣮ�������ʵ��۵㽵�ͣ���Na��Mg��Al��Si��ԭ�Ӿ��壩�����ǽ��������Ƿ��Ӿ��壬�۵�Ƚ������ʵͣ�����������Si��Al��Mg��S��P��Na��Cl2��Ar��ѡ�����⣮ԭ�Ӱ뾶�����Ӱ뾶����С�����������У�����ԭ�������ĵ�����ԭ�Ӱ뾶��С�������Ӱ뾶��Ҫ�����������ӽ������ۣ�������ֻ��2�����Ӳ㣬���ź˵���������뾶��С������������3�����Ӳ㣬���ź˵������������С�����������Ӱ뾶������������Ӱ뾶���������ӵ������ӣ��뾶������ѡ������ �㣮�����Լ������ǽ�������ǿ��ͬһ�����У����ź˵�����ĵ�����Ԫ�صĽ������������ǽ���������ǿ��ѡ�����ȷ���䣮����������Ӧ��ˮ������Լ�����������ǿ��ѡ������ѡ�㣻�����������Ļ�ԭ��Խǿ����Ӧ���ӵ�������Խ�������Ե��������������������ļ���������Na+(��������)���ǽ�����O��S��Ԫ�صķǽ�����Խǿ����Ӧ���⻯��Խ�ȶ��������ȶ��ԣ� H2O��H2S��(3) SiCl4Ϊ���ۻ���������ʽΪ��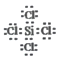 ��(4) M��ˮ��Ӧ����̸��ɫ����A��ӦΪ���ʣ���������ɫ�д�������ζ����B��C��ӦΪ����������Ȼ������壩��������M�ɵ������ڵ���������Ԫ�ذ�ԭ�Ӹ�����1:1��ɣ����ȶ��� M��Ħ������Ϊ135g/mol������֪MΪS2Cl2�����֪DΪ������EΪ���ᡣ��������������֪��M�Ļ�ѧʽΪS2Cl2����C��Ũ��ҺŨ�������Ȼ���Y��Ϊ�������̻�������ط�Ӧ����D�����������ӷ�Ӧ����ʽΪMnO2+2Cl-+4H+=Mn2++Cl2��+2H2O��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����M�е�һ��Ԫ����Ԫ�ؿ��γɻ�����KXO3��KClO3��������ʵ������O2�������Ӵ�����400��ʱKClO3�ֽ�ֻ���������Σ�����һ������������KCl����Ԫ�ػ��ϼ۽��ͣ�����һ��������Ԫ�ػ��ϼ����ߣ����������Ӹ�����Ϊ1��1����ΪKClO4���÷�Ӧ�Ļ�ѧ����ʽΪ��4KClO3
��(4) M��ˮ��Ӧ����̸��ɫ����A��ӦΪ���ʣ���������ɫ�д�������ζ����B��C��ӦΪ����������Ȼ������壩��������M�ɵ������ڵ���������Ԫ�ذ�ԭ�Ӹ�����1:1��ɣ����ȶ��� M��Ħ������Ϊ135g/mol������֪MΪS2Cl2�����֪DΪ������EΪ���ᡣ��������������֪��M�Ļ�ѧʽΪS2Cl2����C��Ũ��ҺŨ�������Ȼ���Y��Ϊ�������̻�������ط�Ӧ����D�����������ӷ�Ӧ����ʽΪMnO2+2Cl-+4H+=Mn2++Cl2��+2H2O��2MnO4-+10C1-+16H+=2Mn2++5Cl2��+8H2O����M�е�һ��Ԫ����Ԫ�ؿ��γɻ�����KXO3��KClO3��������ʵ������O2�������Ӵ�����400��ʱKClO3�ֽ�ֻ���������Σ�����һ������������KCl����Ԫ�ػ��ϼ۽��ͣ�����һ��������Ԫ�ػ��ϼ����ߣ����������Ӹ�����Ϊ1��1����ΪKClO4���÷�Ӧ�Ļ�ѧ����ʽΪ��4KClO3![]() KCl+3KClO4��
KCl+3KClO4��

 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�