题目内容
20.甜樱桃中含有一种羟基酸X,实验测得X的蒸气密度是相同条件下H2密度的67倍,且分子中碳链结构无支链.又已知13.4g X在氧气中完全燃烧只生成17.6g CO2和5.4g H2O.另取等质量的X与足量的碳酸氢钠溶液反应,生成标准状况下的气体4.48L.X在一定条件下可发生如下转化:[X]$→_{△}^{浓H_{2}SO_{4}}$[Y]$\stackrel{Br/CCl_{4}}{→}$[Z]$\stackrel{足量NaOH醇溶液}{→}$[W],其中W的分子式为C4O4Na2.回答下列问题:
(1)X的分子式为C4H6O5,分子中含氧官能团的名称为羟基、羧基.
(2)Z的结构简式为HOOCCHBrCHBrCOOH,X→Y的反应类型是消去反应.
(3)写出Z→W的化学方程式:
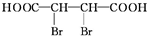 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
分析 羟基酸X即含羟基和羧基,实验测得X的蒸气密度是相同条件下H2密度的67倍,则X的相对分子质量为134,且分子中碳链结构无支链,又已知13.4g即0.1mol X在氧气中完全燃烧只生成17.6g 即0.4molCO2和5.4g即0.3mol H2O,每个分子中含有4个碳原子、6个氢原子,另取等质量的X与足量的碳酸氢钠溶液反应,生成标准状况下的气体4.48L即0.2mol,所以每个分子中两个羧基,所以每个X分子中含有一个羟基、两个羧基,结合X的相对分子质量可知X为HOOCCH2CHOHCOOH,X在浓硫酸加热的条件下发生消去反应生成Y为HOOCCH=CHCOOH,Y与溴发生加成反应生成Z为HOOCCHBrCHBrCOOH,Z在氢氧化钠醇溶液中发生消去反应生成W,W的分子式为C4O4Na2,所以W为NaOOCC≡CCOONa,据此答题.
解答 解:羟基酸X即含羟基和羧基,实验测得X的蒸气密度是相同条件下H2密度的67倍,则X的相对分子质量为134,且分子中碳链结构无支链,又已知13.4g即0.1mol X在氧气中完全燃烧只生成17.6g 即0.4molCO2和5.4g即0.3mol H2O,每个分子中含有4个碳原子、6个氢原子,另取等质量的X与足量的碳酸氢钠溶液反应,生成标准状况下的气体4.48L即0.2mol,所以每个分子中两个羧基,所以每个X分子中含有一个羟基、两个羧基,结合X的相对分子质量可知X为HOOCCH2CHOHCOOH,X在浓硫酸加热的条件下发生消去反应生成Y为HOOCCH=CHCOOH,Y与溴发生加成反应生成Z为HOOCCHBrCHBrCOOH,Z在氢氧化钠醇溶液中发生消去反应生成W,W的分子式为C4O4Na2,所以W为NaOOCC≡CCOONa,
(1)X为HOOCCH2CHOHCOOH,X的分子式为 C4H6O5,分子中含氧官能团的名称为羟基、羧基,
故答案为:C4H6O5;羟基、羧基;
(2)根据上面的分析,Z为HOOCCHBrCHBrCOOH,X→Y的反应类型是消去反应,
故答案为:HOOCCHBrCHBrCOOH;消去反应;
(3)Z→W的化学方程式为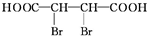 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O,
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O,
故答案为: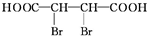 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
点评 本题主要考查有机化学合成与推断、有机方程式、结构简式综合运用,注意有机基础知识的灵活运用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案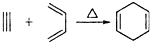 ,如果要合成
,如果要合成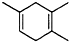 所用的原始原料可以是( )
所用的原始原料可以是( )①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔.
| A. | 只有① | B. | ②③ | C. | ②④ | D. | ①④ |
| A. | 3:11 | B. | 11:3 | C. | 2:3 | D. | 4:3 |
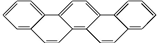 ),是由五个苯环相连形成的.下列有关奥林匹克烃的说法正确的是( )
),是由五个苯环相连形成的.下列有关奥林匹克烃的说法正确的是( )| A. | 该有机物属于芳香族化合物,是苯的同系物 | |
| B. | 能与溴水发生加成反应 | |
| C. | 能使酸性高锰酸钾溶液褪色 | |
| D. | 该烃的分子式为C22H14 |
| 序号 | 实验内容 | 实验目的 |
| A | 在滴有酚酞的Na2CO3溶液中,滴加入BaC12溶液,溶液红色逐渐褪去 | 证明Na2CO3溶液中存在水解平衡 |
| B | 将Al泊插入浓硝酸中,无现象 | 证明Al和浓硝酸不反应 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向同体积同浓度的H2O2溶液中,分别加入1mL同浓度的CuSO4、FeCl3溶液 | 比较Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溶液和胶体的本质区别是有无丁达尔效应 | |
| B. | 玻璃、水泥和光导纤维的主要成分都是硅酸盐 | |
| C. | 氧化钠和过氧化氢含有的化学键种类不同 | |
| D. | 常用的危险化学品酒精和甲烷的标志都是易燃液体 |