题目内容
11.已知: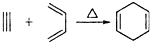 ,如果要合成
,如果要合成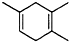 所用的原始原料可以是( )
所用的原始原料可以是( )①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔.
| A. | 只有① | B. | ②③ | C. | ②④ | D. | ①④ |
分析 本题可以采用逆向合成分析法.  或者是
或者是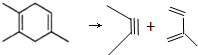 .
.
解答 解:由逆向合成分析法可知,若为 ,则有机物的命名原则两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔;
,则有机物的命名原则两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔;
若为 ,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔;
,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔;
故选:D.
点评 本题主要考查有机物结构式的确定、有机反应方程式的书写,题目难度中等,易错点为对信息的理解,注意正确推断有机物的结构为解答该题的关键.

练习册系列答案
相关题目
2.铵明矾NH4Al(SO4)2•12H2O是分析化学常用基准试剂,其制备过程如下.下列分析不正确的是( )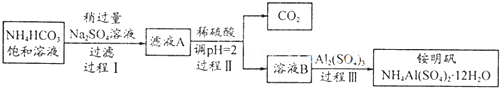

| A. | 过程I反应:2NH4HCO3+Na2SO4═2NaHCO3↓+(NH4)2SO4 | |
| B. | 检验溶液B中阴离子的试剂仅需BaCl2溶液 | |
| C. | 若省略过程II则铵明矾产率明显减小 | |
| D. | 向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失 |
19.铋元素可表示为 83Bi,在元素周期表中相对原子质量为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi元素位于元素周期表第六周期第VA族 | |
| D. | Bi为放射性元素 |
6.现有下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H3=-890kJ•mol-1
④CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H4=-1 367kJ•mol-1
下列说法正确的是( )
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H3=-890kJ•mol-1
④CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H4=-1 367kJ•mol-1
下列说法正确的是( )
| A. | CO(g)的燃烧热比C(s)的燃烧热大 | |
| B. | △H4>△H3>△H2>△H1 | |
| C. | CO(g)具有的能量比CO2(g)高 | |
| D. | 1 mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367 kJ的热量 |
3.合成氨是人类科学技术上的一项重大突破.工业上以天然气为原料合成氨.其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
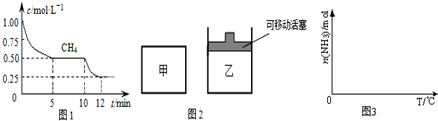
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为5min-10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是a(填序号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在如图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为5min-10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在如图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
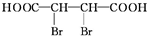 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O. (1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为
(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为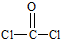 ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号).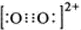 .
.