题目内容
2.以下12种为中学化学中常见的物质:①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩Fe(OH)3 ⑪NaOH⑫NH3•H2O请按下列分类标准回答问题:
(1)属于电解质的是②③⑤⑦⑧⑨⑩⑪⑫.
(2)能电离出H+的是③⑤,属于酸的是⑤.
(3)属于碱的是⑨⑩⑪⑫,其中属于难溶性碱的是⑨⑩.
(4)属于难溶的盐是⑦⑧.
分析 (1)根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
(2)酸或酸式盐能电离出氢离子;
(3)电离出阴离子全是氢氧根离子的化合物为碱;根据物质的溶解性分析;
(4)根据物质的溶解性分析.
解答 解:(1)电解质包括酸、碱、盐、活泼金属氧化物和水,所以②NaCl③NaHSO4属于盐,⑤硫酸属于酸⑦CaCO3属于盐⑧BaSO4属于盐⑨Cu(OH)2 ⑩Fe(OH)3⑪NaOH⑫NH3•H2O属于碱都是电解质,
故答案为:②③⑤⑦⑧⑨⑩⑪⑫;
(2)③NaHSO4 ⑤H2SO4 能电离出氢离子;电离出的阳离子全部是氢离子的化合物为酸,故⑤为酸,故答案为:③⑤;⑤;
(3)⑨Cu(OH)2 ⑩Fe(OH)3⑪NaOH⑫NH3•H2O电离出的阴离子全是氢氧根离子属于碱,其中⑨Cu(OH)2 ⑩Fe(OH)3
难溶于水,属于难溶性碱,故答案为:⑨⑩⑪⑫;⑨⑩;
(4)碳酸钙、硫酸钡不溶于水,都属于难溶性盐,
故答案为:⑦⑧.
点评 本题考查学生酸碱盐概念及溶解性、电解质的判断,注意概念的整理和把握是关键,题目难度不大.

练习册系列答案
相关题目
12.芫荽酮B的结构简式如图所示,下列有关该化合物的说法不正确的是( )
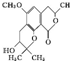

| A. | 每个分子中有2个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1 mol该物质最多可与含2 mol NaOH的水溶液反应 | |
| D. | 分子中有3种含氧官能团 |
10.25℃、101kPa下,二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质的物理量正确的是( )
| O2 | Na2CO3 | CO2 | 转移电子数 | |
| A | 1mol | 0.5NA | ||
| B | 0.5mol | 11.2L | ||
| C | 0.25mol | 53g | ||
| D | 8g | NA |
| A. | A | B. | B | C. | C | D. | D |
7.某同学在实验室配制1000mL 0.50mol•L-1 Na2CO3溶液,用此溶液滴定20.00mL盐酸,用甲基橙作指示剂,恰好完全反应时,消耗溶液的体积为18.00mL,则此盐酸的物质的量浓度为( )
| A. | 0.50mol•L-1 | B. | 0.40mol•L-1 | C. | 0.20mol•L-1 | D. | 0.90mol•L-1 |
2.铵明矾NH4Al(SO4)2•12H2O是分析化学常用基准试剂,其制备过程如下.下列分析不正确的是( )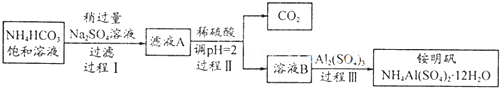

| A. | 过程I反应:2NH4HCO3+Na2SO4═2NaHCO3↓+(NH4)2SO4 | |
| B. | 检验溶液B中阴离子的试剂仅需BaCl2溶液 | |
| C. | 若省略过程II则铵明矾产率明显减小 | |
| D. | 向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失 |
19.铋元素可表示为 83Bi,在元素周期表中相对原子质量为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi元素位于元素周期表第六周期第VA族 | |
| D. | Bi为放射性元素 |
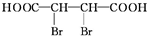 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.