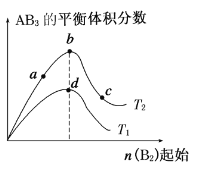
题目内容
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
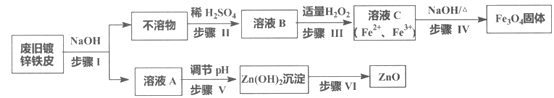
已知反应:①Zn+2NaOH=Na2ZnO2+H2↑ ②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列问题:
(1)步骤I中的分离操作名称是_______,溶液A中的溶质有_______(填化学式)。
(2)步骤III中反应的离子方程式是___________________________________。
(3)步骤IV中反应的离子方程式是____________________________。
(4)步骤V可选用的试剂是_______(填序号)。
a. NaOH溶液 b. 氨水 c. 盐酸
(5)步骤VI的实验操作是______________。
【答案】过滤 Na2ZnO2、NaOH 2Fe2++2H++H2O2=2Fe3++2H2O Fe2++2Fe3++8OH-![]() Fe3O4+4H2O c 灼烧(或加热)
Fe3O4+4H2O c 灼烧(或加热)
【解析】
向废旧镀锌铁皮加入过量的NaOH溶液,发生反应,Zn溶解生成Na2ZnO2和H2,铁不溶解,过滤得到滤液A含有Na2ZnO2、NaOH,调节溶液pH生成Zn(OH)2沉淀,过滤、洗涤、灼烧得到ZnO,固体不溶物A是Fe,将其溶于稀硫酸反应产生FeSO4,向溶液中加入适量H2O2,调节溶液pH=1~2,部分Fe2+被氧化为Fe3+,得到含Fe2+、Fe3+的B溶液,加热促进水解生成Fe3O4胶体粒子。
(1) 步骤I是分离难溶性固体和可溶性液体混合物,该分离操作名称是过滤;溶液A中的溶质有Na2ZnO2、NaOH;
(2)步骤Ⅲ是H2O2在酸性溶液中氧化Fe2+为Fe3+,反应的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O;
(3)步骤IV是向含有Fe2+、Fe3+的溶液中加入NaOH溶液,加热,发生反应产生Fe3O4,同时反应产生水,该反应的离子方程式是Fe2++2Fe3++8OH-![]() Fe3O4+4H2O;
Fe3O4+4H2O;
(4)溶液A含有Na2ZnO2、NaOH,若使Zn2+转化为Zn(OH)2沉淀,步骤Ⅴ是向该混合溶液中加入盐酸,调整溶液的pH,首先发生反应:HCl+NaOH=NaCl+H2O,然后发生:Na2ZnO2+2HCl =2NaCl+ Zn(OH)2↓;故合理选项是c;
(5)步骤VI的实验操作是将Zn(OH)2加热,Zn(OH)2发生分解反应:Zn(OH)2 ![]() ZnO+H2O,故步骤Ⅵ的实验操作是灼烧(或加热。
ZnO+H2O,故步骤Ⅵ的实验操作是灼烧(或加热。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案