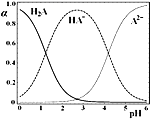
题目内容
【题目】下列说法正确的是
A.CO(g)+3H2(g)=CH4(g)+H2O(g)在一定条件下能自发进行,则该反应的ΔH<0
B.向Na2CO3溶液中加入少量CaCl2固体,溶液的pH增大
C.常温下,向0.1mol·L-1的CH3COONH4溶液中加入少量水,![]() 增大
增大
D.氯碱工业中,常温下每生成3.36 L Cl2时,转移电子数为0.3×6.02×1023
【答案】AC
【解析】
A. CO(g)+3H2(g)=CH4(g)+H2O(g)的ΔS<0,一定条件下使ΔH—TΔS<0,反应才能自发进行,则该反应的ΔH<0,A项正确;
B. Na2CO3+CaCl2= Ca CO3↓+ 2NaCl,溶液碱性减弱,pH减小,B项错误;
C. CH3COONH4水解方程式:CH3COO—+NH4+ + H2O ![]() CH3COOH+NH3·H2O,
CH3COOH+NH3·H2O,
K= ![]() 是常数,
是常数,
变形 ![]() =
= ![]() ,稀释时c(CH3COOH)减小,则
,稀释时c(CH3COOH)减小,则 ![]() 的值增大,C项正确;
的值增大,C项正确;
D. 常温下3.36 L Cl2物质的量不能确定,故转移电子数不能确定,D项错误;
答案选AC。

练习册系列答案
相关题目