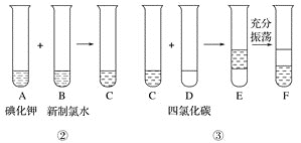
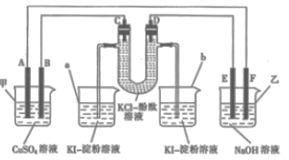
题目内容
【题目】关于Na2CO3与NaHCO3的性质判断正确的是
A. 常温下溶解度:Na2CO3<NaHCO3
B. 热稳定性:Na2CO3<NaHCO3
C. 与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D. 与澄清石灰水反应,均有白色沉淀生成
【答案】D
【解析】
试题A.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故A正确;B.NaHCO3不稳定,加热易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,碳酸钠受热稳定,故B错误;C.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故C错误;D.Na2CO3和Ca(OH)2混合后生成CaCO3,发生Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3可与澄清石灰水发生Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O或Ca(OH)2+2NaHCO3═CaCO3↓+Na2CO3+2H2O,故D正确;故选AD。
Na2CO3+CO2↑+H2O,碳酸钠受热稳定,故B错误;C.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故C错误;D.Na2CO3和Ca(OH)2混合后生成CaCO3,发生Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3可与澄清石灰水发生Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O或Ca(OH)2+2NaHCO3═CaCO3↓+Na2CO3+2H2O,故D正确;故选AD。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3
【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于________(填字母)。

A.交叉分类法
B.树状分类法
(2)人们以_________________________________为分类标准分出溶液、胶体和浊液三种体系,请写出实验室制备Fe(OH)3胶体的化学方程式:______________________________;
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ____________ | ___________ | ___________ | __________ |