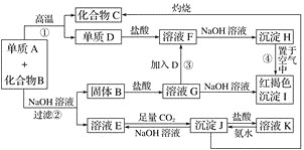
题目内容
【题目】氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g)![]() 2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
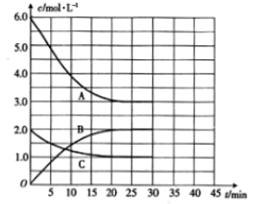
(1)表示N2浓度变化的曲线是___________(填字母),25min时c(NH3)=_________。
(2)0~25min内,用H2浓度变化表示的化学反应速率是_______________。
(3)此温度下,上述反应的平衡常数K的数值为_________________。
(4)若升高温度,则平衡向___________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率__________________。
【答案】 C 2.0mol/L 0.12mol·L-l·min-1 0.15(或4/27) 逆反应 增大 增大
【解析】(1)根据图像可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知曲线C表示N2浓度变化,曲线A表示H2浓度变化,B为氨气的浓度变化曲线,25min时c(NH3)= 2.0mol/L,故答案为:C;2.0mol/L;
(2)前25 min内,氨气浓度增加了2mol/L,则用NH3浓度变化表示的化学反应速率是![]() =0.08 molL-min-1,则用H2浓度变化表示的化学反应速率=
=0.08 molL-min-1,则用H2浓度变化表示的化学反应速率=![]() ×0.08 molL-min-1=0.12mol·L-l·min-1,故答案为:0.12molL-min-1;
×0.08 molL-min-1=0.12mol·L-l·min-1,故答案为:0.12molL-min-1;
(3)根据图像,平衡时N2、H2、NH3的浓度分别为1.0mol/L、3.0mol/L、2.0mol/L,反应的平衡常数K=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(4)该反应为放热反应,升高温度,平衡向逆反应方向移动;正反应速率增大,逆反应速率也增大,故答案为:逆反应;增大;增大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案