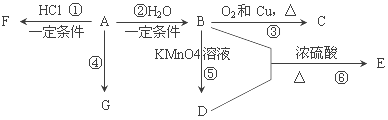
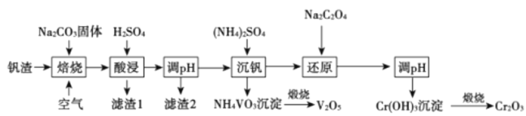
题目内容
【题目】在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
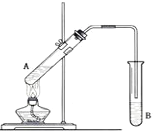
(1)试管B中盛放的溶液是_____________,其作用是:_____________
(2)反应的化学方程式是____________
(3)分离产物用的仪器是___________
【答案】饱和碳酸钠溶液 溶解乙醇、中和乙酸、降低乙酸乙酯的溶解度 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 分液漏斗
CH3COOCH2CH3+H2O 分液漏斗
【解析】
乙醇与乙酸发生酯化反应,从试管A中挥发出的气体有乙酸、乙醇、乙酸乙酯等,分离获得乙酸乙酯需要用饱和碳酸钠溶液,然后再进行分液;
(1)乙醇、乙酸都易挥发,制备的乙酸乙酯中混有乙醇和乙酸,乙酸的酸性强于碳酸,乙醇溶于水,乙酸乙酯是微溶于水的液体,因此通常用饱和碳酸钠溶液溶解挥发出的乙醇,中和挥发出来的乙酸,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,生成乙酸乙酯和水,同时该反应为可逆反应,即反应方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)根据(1)的分析,试管B中液体出现分层,分离时采用分液的方法,即分离产物用到的仪器是分液漏斗。

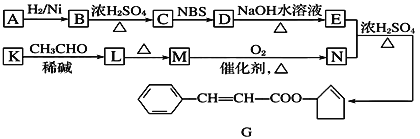
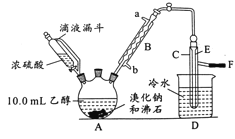
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理为H2SO4(浓)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中进水口为__口(填“a”或“b”)。
(2)实验中用滴液漏斗代替分液漏斗的优点为__。
(3)氢溴酸与浓硫酸混合加热发生氧化还原反应的化学方程式__。
(4)给A加热的目的是__,F接橡皮管导入稀NaOH溶液,其目的是吸收__和溴蒸气,防止__。
(5)C中的导管E的末端须在水面以下,其原因是__。
(6)将C中的镏出液转入锥形并瓶中,连振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,使溶液分层后用分液漏斗分去硫酸层;将经硫酸处理后的溴乙烷转入蒸镏烧瓶,水浴加热蒸馏,收集到35~40℃的馏分约10.0g。
①分液漏斗在使用前必须__;
②从乙醇的角度考虑,本实验所得溴乙烷的产率是__(精确到0.1%)。