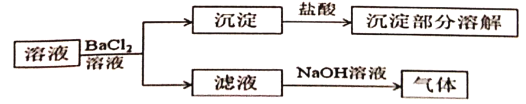
题目内容
【题目】为了探究一种不含结晶水的盐X(仅含5种元素)的组成和性质,将X隔绝空气加热(发生非氧化还原反应)并完成如下实验:
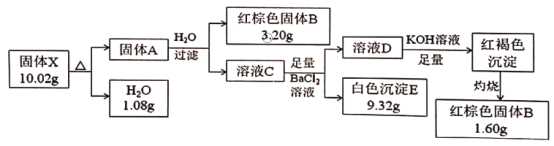
请回答:
(1)X含有的元素有H、O和_____(用元素符号表示)。
(2)X的化学式为____。
(3)向溶液C中通入SO2气体,溶液的酸性增强,其原因是(用离子方程式表示)_____。
【答案】Fe S K ![]() 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
【解析】
固体X加热生成A和水(n(H2O)=![]() =0.06mol,其中n(H)=0.06mol×2=0.12mol),那么X中含有氢、氧两种元素,又X的质量10.02g,水1.08g,那么固体A重8.94g,溶液C中加入氯化钡溶液得白色沉淀和溶液D,可知白色沉淀为硫酸钡(n(BaSO4)=
=0.06mol,其中n(H)=0.06mol×2=0.12mol),那么X中含有氢、氧两种元素,又X的质量10.02g,水1.08g,那么固体A重8.94g,溶液C中加入氯化钡溶液得白色沉淀和溶液D,可知白色沉淀为硫酸钡(n(BaSO4)=![]() =0.04mol),D中加入氢氧化钾溶液得红褐色沉淀,可知红褐色沉淀为Fe(OH)3,灼烧后生成Fe2O3,固体A中含铁n(Fe)=
=0.04mol),D中加入氢氧化钾溶液得红褐色沉淀,可知红褐色沉淀为Fe(OH)3,灼烧后生成Fe2O3,固体A中含铁n(Fe)=![]() =0.06mol,n(正电荷)=0.06mol×3=0.18mol,n(负电荷) =0.04 mol×2= 0.08mol,可知还含有OH-且n(OH-)=0.12mol,那么n(Fe):n(SO42-): n(OH-)=3:2:6,但电荷不守恒,还缺一种带一个单位正电荷的阳离子,由质量守恒可得10.02g-0.06mol×56g/mol-0.04×96g/mol-0.12mol×17g/mol=0.78g,
=0.06mol,n(正电荷)=0.06mol×3=0.18mol,n(负电荷) =0.04 mol×2= 0.08mol,可知还含有OH-且n(OH-)=0.12mol,那么n(Fe):n(SO42-): n(OH-)=3:2:6,但电荷不守恒,还缺一种带一个单位正电荷的阳离子,由质量守恒可得10.02g-0.06mol×56g/mol-0.04×96g/mol-0.12mol×17g/mol=0.78g,![]() ,即n(阳离子)=0.02mol,M(阳离子)=
,即n(阳离子)=0.02mol,M(阳离子)=![]() ,为K,据此回答以下问题。
,为K,据此回答以下问题。
固体X加热生成A和水(n(H2O)=![]() =0.06mol,其中n(H)=0.06mol×2=0.12mol),那么X中含有氢、氧两种元素,又X的质量10.02g,水1.08g,那么固体A重8.94g,溶液C中加入氯化钡溶液得白色沉淀和溶液D,可知白色沉淀为硫酸钡(n(BaSO4)=
=0.06mol,其中n(H)=0.06mol×2=0.12mol),那么X中含有氢、氧两种元素,又X的质量10.02g,水1.08g,那么固体A重8.94g,溶液C中加入氯化钡溶液得白色沉淀和溶液D,可知白色沉淀为硫酸钡(n(BaSO4)=![]() =0.04mol),D中加入氢氧化钾溶液得红褐色沉淀,可知红褐色沉淀为Fe(OH)3,灼烧后生成Fe2O3,固体A中含铁n(Fe)=
=0.04mol),D中加入氢氧化钾溶液得红褐色沉淀,可知红褐色沉淀为Fe(OH)3,灼烧后生成Fe2O3,固体A中含铁n(Fe)=![]() =0.06mol,n(正电荷)=0.06mol×3=0.18mol,n(负电荷) =0.04 mol×2= 0.08mol,可知还含有OH-且n(OH-)=0.12mol,那么n(Fe):n(SO42-): n(OH-)=3:2:6,但电荷不守恒,还缺一种带一个单位正电荷的阳离子,由质量守恒可得10.02g-0.06mol×56g/mol-0.04×96g/mol-0.12mol×17g/mol=0.78g,
=0.06mol,n(正电荷)=0.06mol×3=0.18mol,n(负电荷) =0.04 mol×2= 0.08mol,可知还含有OH-且n(OH-)=0.12mol,那么n(Fe):n(SO42-): n(OH-)=3:2:6,但电荷不守恒,还缺一种带一个单位正电荷的阳离子,由质量守恒可得10.02g-0.06mol×56g/mol-0.04×96g/mol-0.12mol×17g/mol=0.78g,![]() ,即n(阳离子)=0.02mol,M(阳离子)=
,即n(阳离子)=0.02mol,M(阳离子)=![]() ,为K;
,为K;
(1)由以上分析可知X含有的元素有H、O和S、Fe、K;
(2)由分析可知n(K):n(Fe):n(SO42-): n(OH-)=0.02mol:0.06mol:0.04mol:0.12mol=1:3:2:6,那么X的分子式为KFe3(SO4)2(OH)6;
(3)向溶液C中通入SO2气体,溶液的酸性增强,是由于Fe3+与SO2反应,离子反应为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。

 名校课堂系列答案
名校课堂系列答案【题目】化学与社会、生活密切相关,对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体在加热条件下可以完全分解成为气体而除去 |
A.AB.BC.CD.D