题目内容
20.完全燃烧一定量的乙烯与某烃的混合气体后.测得其生成物中气体的质量是反应前混合烃质量的2.86倍,试通过计算求气态烃的分子式及它在混合气体中所占的物质的量分数(气体体积和质量均在常温下测定).分析 测得其生成物中气体的质量是反应前混合烃质量的2.86倍,则混合烃中C的质量分数为:ω(C)=2.86×$\frac{12}{44}$=0.78,乙烯分子中含碳量为:$\frac{12×2}{28}$=0.857>0.78,由于烯烃的最简式相同,其含碳量都是0.78,炔烃的含碳量大于0.78,则另一种烃只能为烷烃,设烷烃通式为CnH2n+2,则$\frac{12n}{14n+2}$<0.78,通过讨论得出n的数值,然后设混合气体中C2H4和CH4共1 mol、CH4的物质的量为x,由题意知:$\frac{44x+88(1-x)}{16x+28(1-x)}$=2.86,据此计算出x,再计算出另一种烃的物质的量分数.
解答 解:生成物中气体的质量是反应前混合烃质量的2.86倍,即:$\frac{m(C{O}_{2})}{m(混合烃)}$=0.286,故混合烃中C的质量分数为:ω(C)=2.86×$\frac{12}{44}$=0.78,
乙烯分子中含碳量为:$\frac{12×2}{28}$=0.857>0.78,
由于烯烃的最简式相同,其含碳量都是0.78,炔烃的含碳量大于0.78,则另一种烃只能为烷烃,
设烷烃通式为CnH2n+2,则$\frac{12n}{14n+2}$<0.78,
解得:n<2,
混合气体中另一种烃分子中C原子数为1,一定是甲烷,
设混合气体中C2H4和CH4共1 mol,其中CH4的物质的量为x,由题意知:$\frac{44x+88(1-x)}{16x+28(1-x)}$=2.86,
解得:x=0.818 mol,
所以混合烃中甲烷的物质的量分数为:$\frac{0.818mol}{1mol}$×100%=81.8%,
答:另一种气态烃为CH4,所占的物质的量分数为81.8%.
点评 本题考查了有机物分子式的确定,题目难度中等,明确“测得其生成物中气体的质量是反应前混合烃质量的2.86倍”含义为解答关键,注意掌握常见烃的分子组成,试题侧重考查学生的分析、理解能力.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案| A. | 对该反应体系加热 | B. | 加入少量NaCl溶液 | ||
| C. | 不用锌片,改用锌粉 | D. | 加入少量1 mol•L-1硫酸 |
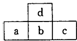 如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱关系为c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | 非金属性:c>b>a | |
| D. | 原子半径:c>b>a>d |
| A. | 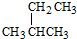 的名称为2-乙基丙烷 的名称为2-乙基丙烷 | |
| B. | CH2═CHCH3不能发生取代反应 | |
| C. | 新戊烷与Br2发生一取代生成两种有机物 | |
| D. | 2-甲基-1,3-丁二烯与等物质的量的Br2发生加成反应的产物有3种 |
| A. | Na+、Ba2+、Cl-、SO42- | B. | Ca2+、HCO3-、Cl-、K+ | ||
| C. | Mg2+、Ag+、NO3-、Cl- | D. | H+、Cl-、Na+、CO32- | ||
| E. | SO32-、Ba2+,H+,NO3- |
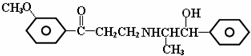
| A. | 可以发生加成反应 | B. | 可以发生消去反应 | ||
| C. | 可以发生银镜反应 | D. | 可以发生酯化反应 |
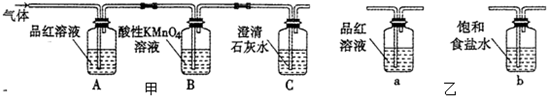

 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O