题目内容
9.硅、锗、磷化锢、氮化镓、聚丙烯睛都是半导体材料.(1)基态锗(Ge)原子的核外电子排布式为1s22s22p63s23p63d104s24p2.
(2)聚丙烯睛由丙烯睛(CH2=CH-CN)聚合而成.丙烯睛分子中所有原子都在同一平面上,则丙烯睛分子中,碳原子的杂化轨道类型有sp2杂化、sp杂化,σ键和π键的个数比为2:1.
(3)(CH3)3Ga、(CH3CH2)3Ga是制取氮化稼的常见镓源,常温常压下均为无色透明的液体.下列说法正确的是AB(填标号).
A.(CH3)3Ga晶体属于分子晶体
B.(CH3)3Ga中所含化学键都是极性键
C.(CH3CH2)3Ga晶体中含有氢键
D.(CH3CH2)3Ga中所有原子都达到稀有气体的稳定结构
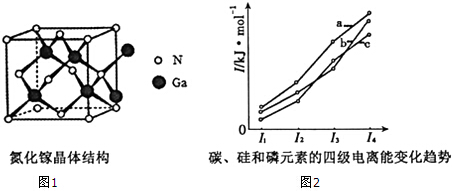
(4)氮化稼(GaN)的晶体结构如图1所示.该晶体中有(填“有”或“无”)配位键存在,判断的依据是氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,而Ga的最外层电子数为3,所以Ga原子提供1个空轨道,N原子提供孤电子对,形成配位键;
(5)图2表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_b(填标号).
分析 (1)Ge是32号元素,其原子核外有32个电子,根据构造原理书写其基态原子核外电子排布式;
(2)A.分子晶体的熔、沸点低;
B.不同非金属元素之间形成极性共价键;
C.根据只有和电负性大的元素(如O,N,F等)相连的H与电负性大的元素(如O,N,F等)相连才能形成氢键;
D.稀有气体的稳定结构:只有1个电子层,有2个电子或最外层为8电子结构;
(3)Ga的最外层电子数为3,而氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,即Ga形成4条共价键;
(4)根据杂化轨道数=σ键数目+孤对电子对数,确定杂化类型;根据1个单键是1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
(5)利用第一电离能大小判断,同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅤA族的大于第ⅥA族的;
解答 解:(1)Ge是32号元素,其原子核外有32个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d104s24p2;
故答案为:1s22s22p63s23p63d104s24p2;
(2)丙烯腈分子CH2=CH-CN中双键上的碳原子形成3个σ键,无孤电子对,sp2杂化,与氮相连的碳原子形成2个σ键,无孤电子对,sp杂化;丙烯腈(CH2=CH-C≡N)分子中含有6个σ键和3个π键,数目之比为 2:1;
故答案为:sp2杂化、sp杂化;2:1;
(3)A.(CH3)3Ga在常温常压下均为无色透明的液体,熔点低,属于分子晶体,故A正确;
B.(CH3)3Ga中所含化学键为碳氢键、碳稼键,都属于极性键,故B正确;
C.(CH3CH2)3Ga晶体中没有电负性大的原子,不能形成氢键,故C错误;
D.(CH3CH2)3Ga中Ga原子最外层只有6个电子,未达到稀有气体的稳定结构,故D错误;
故选:AB.
(4)Ga的最外层电子数为3,而氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,即Ga形成4条共价键,所以Ga原子提供1个空轨道,N原子提供孤电子对,形成配位键;
故答案为:有;氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,而Ga的最外层电子数为3,所以Ga原子提供1个空轨道,N原子提供孤电子对,形成配位键;
(5)同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,第ⅤA族的大于第ⅥA族的,碳第一电离能大于磷,所以碳、硅和磷的第一电离能:碳>磷>硅,故选b.
点评 本题考查电子排布式、化学键的分类与判断、原子的杂化、第一电离能以及有关晶体的性质,难度不大,要求学生对基础知识能够熟练掌握.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案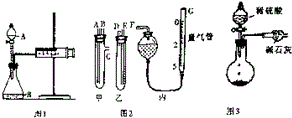 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.(1)甲同学用图1所示装置,把Ng的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积,实验开始时检查该装置气密性的方法是关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气.
(2)乙同学用图2代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛有稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于甲、乙仪器中(填仪器编号);G管可用化学实验室里的一种常用仪器来代替,你认为这种仪器的名称是碱式滴定管;仪器甲、乙、丙接口的连接方式如下:A连接D,B连接E,C连接F(填写各接口的编号).
(3)丙同学用图3装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,使测定结果可能偏小的主要原因可能是装置中的CO2没有全部被碱石灰吸收;(上述偏大、偏小的原因各写一条)
(4)某天然碱可看作向CO2和NaOH的反应后的产物所组成,称取天碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30毫升,产生CO2的体积(标准状况)如下表:
| 样品号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸溶液的体积/mL | 30 | 30 | 30 | 30 |
| 样品质量/g | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积/mL | 672 | 840 | 896 | 672 |
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 通常用来衡量一个国家的石油化学工业发展水平的标志是乙烯的产量 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
| A. | ${\;}_{8}^{17}$O原子核内有9个质子 | B. | H原子核内有1个中子 | ||
| C. | O2和O3互为同位素 | D. | 32He和42He是两种不同的核素 |

 .
. .
.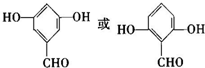 .
.
 .
.
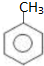 .
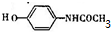
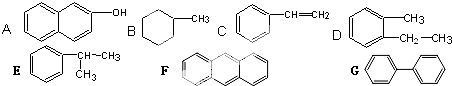
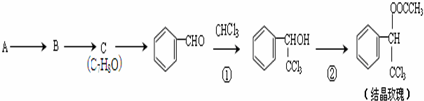
.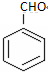 的核磁共振氢谱图中有4组峰.
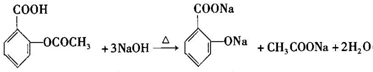
的核磁共振氢谱图中有4组峰.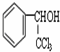 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$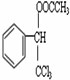 +H2O.
+H2O.