题目内容
14.A、B、C、D代表5种元素.请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为N;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为Cl,C的元素符号为K.用惰性电极电解B、C两元素组成的化合物的水溶液的化学方程式为2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑.
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为Fe,其基态原子的价电子排布式为3d64s2.
分析 (1)次外层有2个电子,则有2个电子层;
(2)在原子中,核电荷数=核内质子数=核外电子数,B元素原子的核电荷数为n,X得到1个电子后变为B-,C失去1个电子后变为C+,根据电子层结构相同,即核外电子数相同,列出等式求解即可;
(3)D元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,应为Fe元素.
解答 解:(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N,其电子排布式为:1s22s22p3,故答案为:N;
(2)设元素B的核电荷数是a,C元素原子的核电荷数为b,因为阴离子B-与阳离子C+电子层结构都与氩相同相同,即核外电子数相同,所以a=18-1=17,b=18+1=19,所以B是Cl,C为K原子,用惰性电极电解氯化钾的水溶液,阳极氯离子放电,阴极氢离子放电生成氢气,所以方程式为:2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,
故答案为:Cl;K;2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑;
(3)D元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,则基态原子的电子排布式为1s22s22p63s23p63d64s2,应为Fe元素,故答案为:Fe;3d64s2.
点评 本题考查元素推断、核外电子排布等,题目难度不大,注意掌握原子核外电子的排布规律,以此推断元素,注意基础知识的理解掌握.

练习册系列答案
相关题目
19.XYZW均为短周期元素,它们在元素周期表中的位置如右图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
| X | Y | |
| Z | W |
| A. | ZWXY的原子半径依次增大 | |
| B. | ZWXY的气态氢化物的稳定性依次减弱 | |
| C. | ZXY原子最外层电子数依次增多 | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
5.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.一定条件下,现有容积相同且恒容的密闭容器甲与乙:①向甲中通入1mol N2和3mol H2,达到平衡时放出热量Q1kJ;②向乙中通入0.5mol N2和1.5mol H2,达到平衡时放出热量Q2 kJ.则下列关系式正确的是( )
| A. | Q1=2Q2=92.4 | B. | 92.4=Q1<2Q2 | C. | 92.4>Ql>2Q2 | D. | Q1=2Q2<92.4 |
19.下列叙述中,正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 在周期表主族元素的最外层电子数等于其主族序数 | |
| D. | 元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素 |
6.2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料.下列关于聚乙炔的叙述错误的是( )
| A. | 聚乙炔是乙炔发生聚合反应形成的高聚物 | |
| B. | 聚乙炔的化学式为 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 聚乙炔不可能发生加成反应 |
3.某种兴奋剂的结构简式如图所示,有关该物质的说法中不正确的是( )
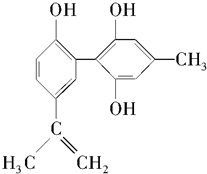

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中不可能所有碳原子共平面 | |
| C. | 该物质能与浓溴水发生加成反应和取代反应 | |
| D. | 1 mol该物质在催化剂作用下最多能与7 molH2发生加成反应 |
4.下列变化过程中,既有离子键又有共价键被破坏的是( )
| A. | I2升华 | B. | 烧碱溶于水 | C. | HCl溶于水得盐酸 | D. | 硫酸氢钠溶于水 |