题目内容
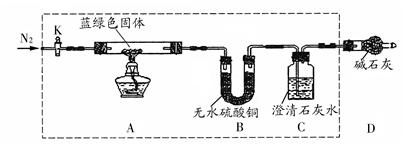
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
(1)ACBECF(2分) AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊。(2分)
(2)关闭(1分) 打开(1分) k和m(2分) 2CH3CH2OH+O2 2CH3CHO+2H2O (2分)
2CH3CHO+2H2O (2分)
(3) ①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度降低而放出;氢氧化钠吸水,促使氨气放出;氢氧化钠电离出的OH-增大了氨水中的OH-浓度,使氨的电离平衡左移,促使氨气放出。(3分)②还原(1分)
解析试题分析:(1)用A装置的NaOH来除CO中混有的CO2,(生成Na2CO3),用C装置检验有没有除尽CO2,B装置是干燥气体的,纯净的CO,通入E中,生成的CO2能使装置C有沉淀,多余的CO在装置F处尾气吸收。
(2)关闭装置A的活塞a,停止通入CO和CO2,打开活塞b,使稀硫酸和A中的碳酸钠反应,产生CO2,通入E,和Na2O2,产生O2,用D吸收O2混有的CO2,用B干燥O2中的H2O,纯净的O2在H中和乙醇发生催化氧化反应。加热k产生乙醇蒸汽,加热m ,是因为乙醇催化氧化需要催化剂铜和加热条件。
(3)这过程发生的反应为4NH3+5O2=4NO+6H2O(NH3表现还原性);2NO+O2=2NO2(红棕色)。
考点:本题以探究实验为基础,考查了元素及化合物知识、探究基本方法、氧化还原反应等实验基础知识。

如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。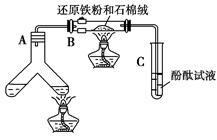
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl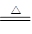 NH4NO2+NaCl
NH4NO2+NaCl
②NH4NO2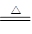 NH3↑+HNO2
NH3↑+HNO2
③2HNO2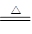 N2O3↑+H2O
N2O3↑+H2O
④2NH3+N2O3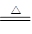 2N2+3H2O
2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
| N2和H2的体积比 | 5∶1 | 3∶1 | 1∶1 | 1∶3 | 1∶5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式________________________。
(2)铁粉撒在石棉绒上的目的是_________________________________
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是________________________。
请你另设计一个简单的实验验证你的理由____________________。欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和________之间。
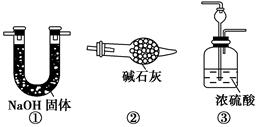
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为________比较适宜;但该装置还难以实现此目的,原因是______________________________________。
(5)实验过程中通入试管C中的气体成分有________。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为_____________________________________。
(2)实验①的目的是_________________________________________________。
实验中滴加FeCl3溶液的目的是_______________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______________________(用实验中所提供的几种试剂)。
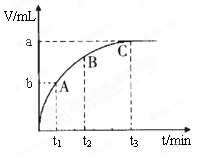
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______。
下列关于教材中的各项说法错误的一项是( )
| A.在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 |
| B.氮肥包括铵态氮肥、硝态氮肥和尿素 |
| C.在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强 |
| D.医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质 |
下列有关叙述正确的是
| A.治理“地沟油”,可通过水解反应制得肥皂 |
| B.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
| C.变质的植物油有难闻的气味,是因为植物油发生了水解反应 |
| D.绿色化学的核心是对环境污染进行治理 |
下列化学方程式错误的是 ( )。
A.Ca(HCO3)2 CaCO3↓+CO2↑+H2O CaCO3↓+CO2↑+H2O |
B.Mg(HCO3)2 MgCO3↓+CO2↑+H2O MgCO3↓+CO2↑+H2O |
C.MgCO3+H2O Mg(OH)2↓+CO2↑ Mg(OH)2↓+CO2↑ |
| D.CaCO3+H2O=Ca(OH)2+CO2↑ |
 CuO + SO3↑ 2SO3
CuO + SO3↑ 2SO3  2SO2↑+ O2↑
2SO2↑+ O2↑
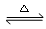 2SO2(g) + O2(g)的平衡常数表达式为K= 。
2SO2(g) + O2(g)的平衡常数表达式为K= 。