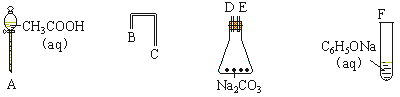��Ŀ����
��ˮ����ͭ��ǿ���»ᷢ���ֽⷴӦ��
CuSO4  CuO + SO3�� 2SO3
CuO + SO3�� 2SO3  2SO2��+ O2��
2SO2��+ O2��
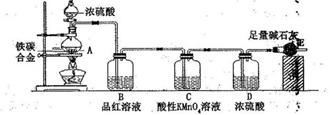
����ͼ��ʾװ�ã��г���������ȥ��������D���ڷ�Ӧǰ��������������ֽ��˵���ˮ����ͭ��������
ʵ�鲽�裺
�ٳ�����ӦǰD�ܵ�������
�����Ӻ�װ�ã��ر�K������Ӳ�ʲ�����Aһ��ʱ���ֹͣ���ȡ�
�۴�Ӳ�ʲ�����A��ȴ��K��ͨ��һ��ʱ����ѳ�ȥ������̼����������Ŀ�����
���ٳ���D�ܣ����䷴Ӧǰ���������Ϊm��
�ش��������⣺
��1����Ӧ2SO3(g)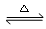 2SO2(g) + O2(g)��ƽ�ⳣ������ʽΪK= ��
2SO2(g) + O2(g)��ƽ�ⳣ������ʽΪK= ��
��2��B���г��¶����������⣬���ɿ����������� �����¶��������ߵ���Ҫԭ���� ��B���з�����Ӧ���й����ӷ���ʽ�� ��
��3������E�������� ��
��4������������ʵ�飬����B��C��D����������վ���ȫ�������Կ�����CO2��Ӱ�죬�ܷ����m������ֽ��˵���ˮCuSO4��������(��ѡ��һ�ش�)
������ܣ���ֽ����ˮCuSO4������Ϊ ����m��ʾ����
��������ܣ���ԭ���� ��Ϊ���ܲ�÷ֽ��˵���ˮ����ͭ����������ļ�ʵ�鷽���� ��
��13�֣���1��K=c(O2)��c2(SO2) / c2(SO3) ��1�֣�
(2) ������ð����������ɫ������2�֣� SO3����ˮ���ȣ�2�֣�
SO3 + H2O + Ba2��= BaSO4��+ 2H��
��SO3 + H2O = 2H��+ SO42����Ba2��+ SO42��= BaSO4����2�֣�
��3�����տ����е�ˮ������CO2��2�֣�
��4����SO3������ȫ�ֽ�ΪSO2��O2��SO2�Ჿ���ܽ�����Һ�У�2�֣�
����װ����ˮ����ͭ��A��������ǿ��һ��ʱ�����ȴ���ٳ���A������������A���ڷ�Ӧǰ��������������ֽ��˵���ˮ����ͭ��������2�֣�
���������������1��ƽ�ⳣ������������Ũ����֮�����Է�Ӧ��Ũ����֮����������ʹ�Һ�岻��д�����ʽ����2����ˮ����ͭ���ȷֽ�ų�SO3��SO2��O2�Ļ�����壬װ��B�з�����ӦSO3+H2O=H2SO4��H2SO4+BaCl2=BaSO4��+2HCl��ǰ�߷��ȣ����߲�����ɫ����SO2��O2���ܷ�Ӧ����װ��B���������ݳ����ܷ�ӦʽΪSO3 + H2O + Ba2��= BaSO4��+ 2H������3����ʯ����NaOH��CaO��ɵĻ��������ն�����̼��ˮ����ֹ���ǽ���װ��D���ų������е�ˮ�����Ͷ�����̼�ĸ��ţ���4�����ܸ���װ��D�ڷ�Ӧǰ���������m������ˮ����ͭ�ֽ��˵�������ԭ���ǣ���SO3������ȫ�ֽ�ΪSO2��O2����SO2�Ჿ���ܽ�����Һ�У���ȷ�����dz���װ����ˮ����ͭ��A��������ǿ��һ��ʱ�����ȴ���ٳ���A������������A���ڷ�Ӧǰ��������������ֽ��˵���ˮ����ͭ��������
���㣺���黯ѧʵ�鷽������������ۣ��漰ƽ�ⳣ������ʽ����д��ʵ�����������������ԭ�����ӷ���ʽ����д����������;��ʵ�鷽������������Ƶȿ��㡣

��1��С���������о��¶ȶԷ�Ӧ���ʵ�Ӱ�족ʵ��ʱ����ȡ����ֻ�Թܣ�������4mL 0.01mol��L��KMnO4������Һ��2mL 0.1mol/L H2C2O4���Ҷ��ᣩ��Һ����A�Թ�������ˮ�У�B�Թ�������ˮ�У���¼��Һ��ɫ�����ʱ�䡣
����Ҫ�� ���ữKMnO4��Һ����ɫ����ʱ��tA tB���>������=����<������
��д���÷�Ӧ�����ӷ���ʽ ��
��2��ʵ������ƿ������ɳ���Ҷ�����Ʒ��С�����������Ӧ��ԭ�����ⶨ�京�����������Ϊ��
������250 mL��Һ��ȷ����5.0g�Ҷ�����Ʒ�����250mL��Һ��
�ڵζ���ȷ��ȡ25.00 mL������Һ����ƿ�У����������ữ����0.1000 mol��L��1 KMnO4��Һװ�� �����ʽ����ʽ�����ζ��ܣ����еζ�������
��ʵ���з��֣��յ�������KMnO4��Һʱ����ҺѸ�ٱ���Ϻ�ɫ������ƿҡ��һ��ʱ����Ϻ�ɫ������ʧ���ټ����μ�ʱ���Ϻ�ɫ�ͺܿ���ɫ�ˡ������ԭ��
����____
��֤���ﵽ�ζ��յ㡣
�ۼ��㣺���ظ���������2�Σ���¼ʵ���������¡�
| ��� | �ζ�ǰ������mL�� | �ζ��������mL�� |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 1.10 | 21.10 |
������KMnO4��Һ��ƽ�����Ϊ mL����֪H2C2O4����Է�������Ϊ90�������Ʒ�Ĵ���Ϊ ��
�������������в����ᵼ�²ⶨ���ƫ�ߵ��� ��
A��δ�ñ�Ũ�ȵ�����KMnO4��Һ��ϴ�ζ���
B���ζ�ǰ��ƿ������ˮ
C���ζ�ǰ�ζ��ܼ��첿�������ݣ��ζ���������ʧ
D����С�Ľ���������KMnO4��Һ������ƿ��
E���۲����ʱ���ζ�ǰ���ӣ��ζ�����
����˵����ȷ��
| A�����ع��͡������ܻ��������ڱ��������������ʣ������ڸ߷��ӻ�������Խ����к� |
| B��������ˮʱ�����˻�ѧ�������仯������ɱ�������������� |
| C�������Ѿƴ���ʱ�䳤���������Ϊ�Ҵ�������������Ӧ |
| D�����ơ����Ƚ���Ԫ�ص�������Ѥ������ɫ��������������� |
 NH2COONH4(s) ��H��0
NH2COONH4(s) ��H��0