题目内容
(15分)某兴趣小组的同学发现,将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。
Ⅰ.【提出猜想】
猜想1:所得沉淀为 ;
猜想2:所得沉淀为 ;
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2·nCuCO3]。
Ⅱ.【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
Ⅲ.【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;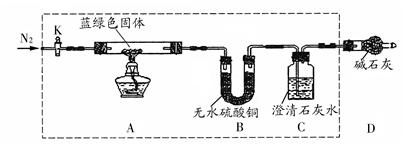
Ⅳ.【问题讨论】
能证明猜想1成立的实验现象是 ;
(1)检查上述虚线框内装置气密性的实验操作是:关闭K, ;
(2)若在上述装置B中盛放无水CaCl2,C中盛放Ba(OH)2溶液,还可以测定所得沉淀的组成。
①C中盛放Ba(OH)2溶液,而不使用澄清石灰水的原因是 ;
②若所取蓝绿色固体质量为27.1 g,实验结束后,装置B的质量增加2.7 g,C中产生沉淀的质量为19.7 g 。则该蓝绿色固体的化学式为 。
(15分)
Ⅰ.猜想1:Cu(OH)2; (2分) 猜想2:CuCO3; (2分)
Ⅳ.现象:B中白色固体变蓝,C中无明显现象;(2分)
(若猜想1为CuCO3,则现象为:B中无明显现象,C中产生白色沉淀。)
(1)用酒精灯微热横玻璃管,若C中有气泡逸出,撤灯冷却一段时间,C中导管内形成水柱,则证明此装置气密性良好;(3分)
(2)① Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2;(2分)且M(BaCO3)大于
M(CaCO3),测量误差小;(2分)
②Cu5(OH)6(CO3)2(或:2CuCO3????3Cu(OH)2 )。(2分)
解析试题分析:Ⅰ.根据Cu元素可能生成的沉淀的形式猜想。所得沉淀可能是Cu(OH)2或者是 CuCO3;
Ⅳ.如果沉淀是氢氧化铜,则受热分解生成氧化铜和水,无水硫酸铜与水结合生成蓝色固体,则B中白色固体变蓝,C中无明显现象;若沉淀是碳酸铜,则受热分解生成氧化铜和二氧化碳,二氧化碳使澄清石灰水变浑浊,则对应现象是B中无明显现象,C中产生白色沉淀。
(1)装置气密性的检查依据气体的压强原理,容器体积不变时,温度升高,压强增大。所以检查上述虚线框内装置气密性的实验操作是:用酒精灯微热横玻璃管,若C中有气泡逸出,撤灯冷却一段时间,C中导管内形成水柱,则证明此装置气密性良好;
(2)①若在上述装置B中盛放无水CaCl2,C中盛放Ba(OH)2溶液,则根据装置增重的质量来测定沉淀的组成。C中盛放Ba(OH)2溶液,Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2;且M(BaCO3)大于M(CaCO3),测量误差小;
②装置B的质量增加2.7 g,C中产生沉淀的质量为19.7 g 。,说明27.1g的沉淀分解生成0.15g H2O,0.1mol CO2,则CuO的质量是4.7g,物质的量是0.25mol,所以沉淀中n(Cu):n(OH-):n(CO32-)=0.25:0.3:0.1=5:6:2,所以该沉淀的化学式为Cu5(OH)6(CO3)2.
考点:考查对实验的分析,装置气密性的检查,试剂的选择,化学式的计算

(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因:
。当____
,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 1.10 | 21.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
(14分)正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下: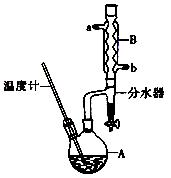
2CH3CH2CH2CH2OH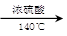 (CH3CH2CH2CH2)2O + H2O
(CH3CH2CH2CH2)2O + H2O
反应物和产物的相关数据如下
| | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 |
| 正丁醇 | 74 | 117.2 | 0.819 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
(2)加热A前,需先从____(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应从分液漏斗
的 (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的是 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
a.100℃ h. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为____,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。
化学与生活宙哪相关,下列用选、性质或变化对应正确的是
| A.利用粮食酿酒的化学过程包含:淀粉一→葡萄糖一→己醇 |
| B.在月饼包装袋中放人生石灰:防止食物氧化变质 |
| C.焰火的绚丽:说明只有金属单质能发生焰色反应 |
| D.氢氧化铝用于清疗胃酸过多:氢氧化锯碱性强 |
生活是化学的源泉,下列有关生产、生活中的化学叙述错误的是( )
| A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B.变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 |
| C.一定浓度的双氧水可用于伤口的消毒 |
| D.采煤工业上,爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾 |
 杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。