题目内容
6.下列说法正确的是( )| A. | 该  有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. |  该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol |
分析 A.有机物主链含有7个C原子,有2个侧链,分别为甲基和乙基;
B.烷烃的含碳量小于烯烃;
C.含有羟基和醛基,羟基可发生取代、消去反应,醛基可发生加成、氧化和还原反应;
D.能与氢氧化钠反应的为酯基、酚羟基、Br原子,且可水解生成酚羟基、HBr和碳酸等.
解答 解:A.有机物主链含有7个C原子,有2个侧链,分别为甲基和乙基,主链从左端编号,名称为3-甲基-5-乙基庚烷,故A错误;
B.烷烃的含碳量小于烯烃,则等质量时烯烃生成的二氧化碳质量偏大,故B错误;
C.含有羟基和醛基,羟基可发生取代、消去反应,醛基可发生加成、氧化和还原反应,故C正确;
D.有机物含有2个酯基、2个Br原子,1个酚羟基和一个肽键,与氢氧化钠反应的为酯基、酚羟基、Br原子,且可水解生成酚羟基、HBr和碳酸等,则1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH9mol,故D错误.
在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH9mol,故D错误.
故选C.
点评 本题综合考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,题目涉及有机物的名称以及有机物组成的判断,注意把握有机物官能团的种类和性质,难度中等.

练习册系列答案
相关题目
15.科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图.下列说法中不正确的是( )

| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个互相垂直的直线上 | |
| D. | 分子中既有C-C键也有C=C键 |
10.X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如表:
(1)W位于元素周期表第三周期第ⅢA族;W的简单离子半径比Z的简单离子半径小(填“大”或“小”).
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是3d104s1.
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线形.
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)═4ZO2(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)═2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| 元素 | 相关信息 |
| X | 元索周期表中核电荷数最小的元素 |
| Y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量最多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是3d104s1.
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线形.
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)═4ZO2(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)═2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
13.某有机物在氧气里充分燃烧,生成CO2和H2O的质量比为22:9,由此可得出的正确的结论是( )
| A. | 碳、氢、氧的原子个数比为1:2:3 | |
| B. | 碳、氢的原子个数比为1:1 | |
| C. | 该有机物中肯定不含氧元素 | |
| D. | 不能判断该有机物中是否含有氧元素 |
9.以NA表示阿伏加德罗常数的值,下列说法错误的是( )


| A. | 18g冰(图1)中含O-H键数目为2NA | |
| B. | 28g晶体硅(图2)中含有Si-Si键数目为2NA | |
| C. | 44g干冰(图3)中含有NA个晶胞结构单元 | |
| D. | 石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C-C键数目为1.5NA |
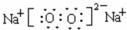 .
. 某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.
某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.

 (R、R′表示烃基或氢)
(R、R′表示烃基或氢) ,E的结构简式是CH3CHO.
,E的结构简式是CH3CHO.
 .
.