��Ŀ����
����Ŀ�����в���Ԫ�ص�������ԭ��(�����)�ṹ���±���ʾ��
Ԫ�ر�� | Ԫ��������ԭ��(�����)�ṹ |
T | �����������Ǵ�����������3�� |
X | �������������۵Ĵ�����Ϊ2�������µ���Ϊ���� |
Y | M���K����1������ |
Z | ��������Ԫ�صĽ��������а뾶��С |
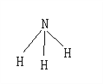
��1������Ԫ��T��ԭ�ӽṹʾ��ͼ��_________________��
��2��Ԫ��Y��Z��Ƚ����Խ�ǿ����Y�����в���֤����һ��ʵ����____(����ĸ)��
a��Y��������������Z��
b��Y������ˮ��Ӧ��Z������ˮ��Ӧ����
c��Y����������Ӧ��ˮ����ļ��Ա�Z��ǿ
��3��д��X�γɵ��ʵĵ���ʽ_________________������Ԫ�ط��ű�ʾ��
��4��T�����γ��ȶ���������Tm-��Y�����γ��ȶ���������Yn+����뾶��ϵΪr(Tm-) ______ r��Yn+�����>��,��<����=����
��5��X��Y��Z������������Ӧ��ˮ��������������Ӧ��д��Y��Z������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽ___________________________��
���𰸡� ![]() a
a ![]() > Al(OH)3+OH-=AlO2-+2H2O
> Al(OH)3+OH-=AlO2-+2H2O
��������T�����������Ǵ�����������3��, ��TΪOԪ�أ�X�������������۵Ĵ�����Ϊ2�������µ���Ϊ���壬����XΪNԪ�أ�YԪ�ص�ԭ�Ӻ���M���K����1�����ӣ���![]() ����YΪNaԪ�أ�Z�ǵ������ڽ��������а뾶��С�ģ�����ZΪAlԪ�ء�(1)OԪ�ص�ԭ�ӽṹʾ��ͼΪ
����YΪNaԪ�أ�Z�ǵ������ڽ��������а뾶��С�ģ�����ZΪAlԪ�ء�(1)OԪ�ص�ԭ�ӽṹʾ��ͼΪ![]() ��
��
(2)�����������Ķ��ٲ���֤�������Ե�ǿ������a����Na��ˮ��Ӧ��Al��ˮ��Ӧ���ң�֤��Na�Ľ����Ա�Al��ǿ����b��ȷ��NaOH �ļ���ǿ��Al(OH)3�ģ�֤��Na�Ľ����Ա�Al��ǿ����c��ȷ�������ȷ��Ϊa��
(3)�����ĵ���ʽΪ![]() ��
��
(4)O2����Na+������ͬ�ĵ��Ӳ�ṹ�����˵����O2��С��Na+���������Ӱ뾶Ϊr(O2��)> r(Na+)��
(5)Y��Z������������Ӧ��ˮ����ֱ���NaOH��Al(OH)3�����߷�Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O��

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�����Ŀ����������ʵ���г�����Ӧ������ȷ���ǣ� ��
ʵ����ʵ | ���� | |
�� | ͭ����������ɫ�ij�Ϊͭ�� | ͭ�������ܵ�����Ĥ |
�� | Ũ����ɳ�ȥ��ƿ�ڲ�����MnO2 �� ϡ����ɳ�ȥ�Թ��ڱڵ���������ĥ�ڲ���ƿ����NaOH��Һ | ��������������ԭ��Ӧ |
�� | ����CO2ͨ��Na[Al��OH��4]��Һ������ɫ������Na2CO3 | ���ԣ�HCO3����Al��OH��3 |
�� | ij��Һ����ϡ���������ʹ����ʯ��ˮ����ǵ���ɫ��ζ���壬����Һ�μ�CaCl2��Һ���а�ɫ�������� | ȷ������Һ����CO |
�� | ij��ɫ��Һ�м���Ũ����������Һ�����ȣ�������������ʹʪ���ɫʯ����ֽ���� | ����Һһ����NH |
A.�ڢۢ�
B.�٢ڢ�
C.�ۢܢ�
D.ȫ��