题目内容
18.有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,D的最高正价与最低负价的代数和为4,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:(1)A是H,D是S,E是K.
(2)写出B元素原子的轨道表示式
 .
.(3)写出C元素原子的电子排布式1s22s22p63s23p1.
(4)E与B、D所形成的化合物的微粒间作用力是离子键、共价键.
(5)写出A和B形成的化合物的电子式
 、
、 .
.
分析 A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,D的最高正价与最低负价的代数和为4,则D处于VIA族,B和D同族,则B为O元素、D为S元素;C元素原子的最外层电子数是D元素原子最外层电子数的一半,则C原子最外层电子数为3,结合原子序数可知C为Al;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,结合C、E是金属元素,则A为H元素、E为K元素,据此解答.
解答 解:A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,D的最高正价与最低负价的代数和为4,则D处于VIA族,B和D同族,则B为O元素、D为S元素;C元素原子的最外层电子数是D元素原子最外层电子数的一半,则C原子最外层电子数为3,结合原子序数可知C为Al;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,结合C、E是金属元素,则A为H元素、E为K元素.
(1)由上述分析可知,A是H元素,D是S元素,E是K元素,故答案为:H;S;K;
(2)B为O元素,原子的轨道表示式为: ,故答案为:
,故答案为: ;
;
(3)C为Al元素,原子的电子排布式为:1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(4)E与B、D所形成的化合物为K2SO4等,属于离子化合物,酸根离子中原子之间形成共价键,微粒间作用力是离子键、共价键,故答案为:离子键、共价键;
(5)A和B形成的化合物为H2O、H2O2,电子式为 、
、 ,
,
故答案为: 、
、 .
.
点评 本题考查结构性质位置关系,推断元素是解答的关键,题目难度不大,旨在考查学生对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列除杂的方法正确的是( )
| A. | 除去N2中的少量O2:通过灼热的CuO粉末,收集气体 | |
| B. | 除去CO2中的少量HCl:通入过量NaOH溶液,收集气体 | |
| C. | 除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤 | |
| D. | 除去NaCl溶液中少量CaCl2:加入过量Na2CO3溶液,过滤,滤液中再加入过量盐酸,加热 |
13.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
3.某酸式盐NaHY的水溶液中存在c(OH-)>c(H+),则下列叙述正确的是( )
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY-的水解方程式:HY-+H2O?H3O++Y2- | |
| C. | 该酸式盐溶液中粒子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-) |
8.2010年上海世博会的主题是“城市,让生活更美好”下列叙述不正确的是( )
| A. | 某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 | |
| B. | 世博会期间,利用可降解的“主米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博会中国馆“东方之冠”使用的钢筋混凝土属于高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NO 转化为无毒气体CO2和N2 |
 电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO${\;}_{3}^{-}$含量会增加.
电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO${\;}_{3}^{-}$含量会增加.
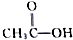 、
、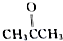 及
及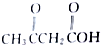 .根据上述事实推测A可能的构造式.
.根据上述事实推测A可能的构造式.