题目内容
14.我国北方某盐湖生产的纯碱(Na2CO3)产品中常含少量的氯化钠,为测定该产品中碳酸钠的质量分数,现称取6g样品于烧杯内,滴加稀盐酸至烧杯内溶液的PH=7,消耗稀盐酸的质量为36.5g,同时测得反应后溶液的总质量为40.3g.请计算:(1)反应生成的气体质量为2.2g.
(2)该样品中碳酸钠的质量分数.(结果精确至0.1%)
分析 (1)发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所得溶液质量=样品质量+稀盐酸质量-二氧化碳的质量,据此计算生成二氧化碳的质量;
(2)根据方程式计算碳酸钠的质量,碳酸钠质量分数=$\frac{碳酸钠质量}{样品质量}$×100%.
解答 解:(1)发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所得溶液质量=样品质量+稀盐酸质量-二氧化碳的质量,故生成气体的质量=6g+36.5g-40.3g=2.2g,
故答案为:2.2;
(2)设纯碱样品中Na2CO3的质量为x,则:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
所以x=$\frac{2.2g×106}{44}$=5.3g,
纯碱样品中Na2CO3的质量分数为:$\frac{5.3g}{6g}$×100≈88.3%,
答:纯碱样品中Na2CO3的质量分数为88.3%.
点评 本题考查混合物有关计算,关键是计算二氧化碳的质量,难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
5.下列关于有机化合物的说法不正确的是( )
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 戊烷有3种同分异构体 | D. | 油脂的皂化反应属于水解反应 |
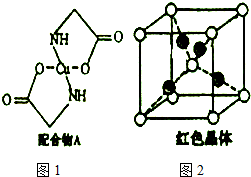
19.A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素.A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2-和D+具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2.由这些元素组成的物质,其组成和结构信息如下表:
请用化学用语回答下列问题:
(1)D+的结构示意图为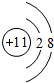 ;
;
(2)C、D、E的氢化物按熔点由高到低排列的顺序为NaH>H2O>PH3;
(3)乙属于极性分子(填“极性”或“非极性”),丁的电子式为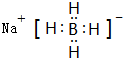 ,
,
(4)将少量甲投入到AlCl3溶液中反应的离子方程式为6Na2O2+4Al3+6H2O=4Al(OH)3↓+3O2↑+12Na+;
(5)氮化硼晶体的熔点要比丙晶体高,其原因是磷原子半径比氮原子大,N-B共价键键长比B-P小,则N-B键能大.
| 物质 | 组成和结构信息 |
| 甲 | 含有非极性共价键的常见二元离子化合物 |
| 乙 | 含有极性键和非极性键的18e-分子 |
| 丙 | 化学组成为BE,熔点高,可作超硬耐磨涂层材料 |
| 丁 | 化学组成为DBA4的离子化合物 |
(1)D+的结构示意图为
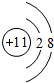 ;
;(2)C、D、E的氢化物按熔点由高到低排列的顺序为NaH>H2O>PH3;
(3)乙属于极性分子(填“极性”或“非极性”),丁的电子式为
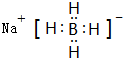 ,
,(4)将少量甲投入到AlCl3溶液中反应的离子方程式为6Na2O2+4Al3+6H2O=4Al(OH)3↓+3O2↑+12Na+;
(5)氮化硼晶体的熔点要比丙晶体高,其原因是磷原子半径比氮原子大,N-B共价键键长比B-P小,则N-B键能大.
3.用pH传感器测得0.10mol•L-1Na2CO3溶液从55℃升高至85℃的pH如图所示.在55℃升高至85℃升温过程中,下列说法正确的是( )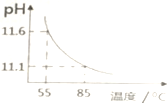

| A. | c(H+)增大,c(OH-)减小 | B. | $\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$比值不断增大 | ||
| C. | c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 | D. | c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1 |
4.0.3mol O2和0.2mol O3,下列量相等的是( )
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |