题目内容
【题目】一定量Na2O2和NaHCO3均匀混合物分成质量相等的甲乙两份。将甲投入100mL稀盐酸,固体完全溶解,收集到标况下的干燥气体2.24L。再将生成的气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为2.016L。根据以上信息,下列有关推断不正确的是( )
A. 甲乙两份混合物中均含Na2O2 0.16mol
B. 甲乙两份混合物中均含NaHCO3 0.02mol
C. 原混合物中Na2O2和NaHCO3物质的量之比无法确定
D. 盐酸物质的量浓度可能为3.4mol/L
【答案】C
【解析】2.24L混合气体的物质的量为![]() =0.1mol,标况下2.016L的单质气体为氧气,2.016LO2的物质的量为:
=0.1mol,标况下2.016L的单质气体为氧气,2.016LO2的物质的量为:![]() =0.09mol,则:
=0.09mol,则:
2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n
2 2 1
n(Na2O2)n(CO2)0.1mol-0.09mol=0.01mol
所以, n(Na2O2)= n(CO2) =0.02mol,
由于CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol,则:
2Na2O2 +4HCl=4NaCl+2H2O+O2↑
0.16mol 0.32mol0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol
所以消耗的HCl为:0.32mol+0.02mol=0.34mol,当氯化氢完全反应时,盐酸的物质的量浓度为:![]() =3.4mol/L,故D正确;每份中含有过氧化钠的物质的量为0.16mol,故A正确;每份中含有碳酸氢钠为0.02mol,故B正确;根据以上分析可知,能够确定碳酸氢钠、过氧化钠的物质的量之比为1:8,故C错误;故选C。
=3.4mol/L,故D正确;每份中含有过氧化钠的物质的量为0.16mol,故A正确;每份中含有碳酸氢钠为0.02mol,故B正确;根据以上分析可知,能够确定碳酸氢钠、过氧化钠的物质的量之比为1:8,故C错误;故选C。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
一.溴乙烷的制备
反应原理和实验装置如下(加热装置、夹持装置均省略):
H2SO4+NaBr![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
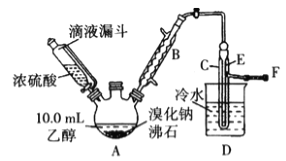
(1)图中沸石的作用为_____________。若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应生成了________;F连接导管通入稀NaOH溶液中,其目的主要是吸收_________等防止污染空气;导管E的末端须低于D中烧杯内的水面,其目的是_______________________________。
(2)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。从乙醇的角度考虑,本实验所得溴乙烷的产率是_____________(保留3位有效数字)。
二.溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3)在乙中试管内加入10mL6mol·L-1NaOH溶液和2mL溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______________________________________,证明溴乙烷与NaOH溶液已反应完全的现象是________________________________。
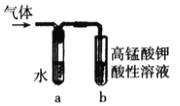
(4)若将乙中试管里的NaOH溶液换成NaOH乙醇溶液,为证明产物为乙烯,将生成的气体通入如图装置。a试管中的水的作用是________________;若无a试管,将生成的气体直接通入b试管中,则b中的试剂可以为______________。
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16 mol 充入 10 L 恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.该温度下,此反应的平衡常数 K=1.44
B.4min 时,ν(逆)>ν(正)
C.反应前 2min 的平均速率 ν(Z)=2.0×10-3mol/(L·min)
D.7min 时,反应还未达到平衡状态