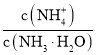题目内容
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)以CO2与NH3为原料合成尿素[CO(NH2)2]的技术已十分成熟。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.47 kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+28.49kJmol-1
③H2O(g)=H2O(l) △H=-88.0kJmol-1
则NH3和CO2合成尿素和气态水的热化学方程式为___。
(2)已知:工业上在120℃条件下利用NH3和CO2合成尿素。在恒温恒容条件下,下列能说明合成尿素反应达平衡的是___
A.NH3和CO2的比例保持不变
B.混合气体的压强不再发生变化
C.2v(NH3)(正)=v(CO2)(逆)
D.混合气体的密度不再改变
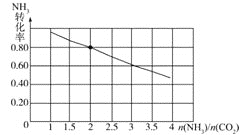
(3)氨碳比[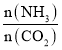 ]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[
]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[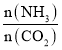 ]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
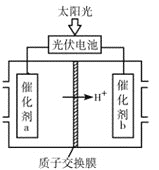
(4)研究人员设计出一种新型太阳能电池,能直接把CO2和H2O转化为CO、H2和O2,原理如图所示,该装置中能量转化方式为___,催化剂b表面的电极反应式为___。
【答案】2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1 BD 3.75 64 太阳能转化为电能,电能转化为化学能 2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)、2H++CO2+2e-=CO+H2O
【解析】
(1)根据盖斯定律进行计算;
(2)根据化学平衡状态判断标准正逆反应速率相等;各组分浓度保持不变及由此衍生的物理量进行分析;
(3)根据三段式进行分析计算转化率及平衡常数;
(4)由图可知,该装置中能量转化方式为太阳能转化为电能,电能转化为化学能;由图可知,催化剂b一侧为正极,氢离子、二氧化碳得电子发生还原反应。
![]() 由热化学方程式和盖斯定律,反应
由热化学方程式和盖斯定律,反应![]() 可得
可得![]() 和
和![]() 合成尿素和气态水的热化学方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1,
合成尿素和气态水的热化学方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-42.98kJmol-1;
![]() 如果
如果![]() 和
和![]() 最初按化学计量数充入,则无论平衡与否,其比例保持不变,故A错误;
最初按化学计量数充入,则无论平衡与否,其比例保持不变,故A错误;
B.在恒温恒容条件下,反应达平衡时混合气体的物质的量不再变化,压强也不再发生变化,故B正确;
C.当![]() 正
正![]() 逆
逆![]() 时反应达平衡状态,故C错误;
时反应达平衡状态,故C错误;
D.达平衡时混合气体的质量不再改变,在恒温恒容条件下密度也不再改变,故D正确,
故选BD;
![]() 根据题意,由三段式:
根据题意,由三段式:![]()
起始量 2x x 0 0
转化量 2 1 1 1
平衡量 ![]()
![]() 1 1
1 1
当![]() 时,由图可知
时,由图可知![]() 的转化率为
的转化率为![]() ,则
,则![]() ,
,![]() ,
,
总物质的量为![]() ,此温度下该反应的化学平衡常数
,此温度下该反应的化学平衡常数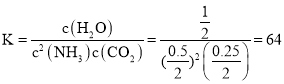 ,
,
故答案为:64;
![]() 由图可知,该装置中能量转化方式为太阳能转化为电能,电能转化为化学能;由图可知,催化剂b一侧为正极,其表面的电极反应式为:
由图可知,该装置中能量转化方式为太阳能转化为电能,电能转化为化学能;由图可知,催化剂b一侧为正极,其表面的电极反应式为:![]() 或
或![]() 、
、![]() ,
,
故答案为:![]() 或
或![]() 、
、![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:___________________________________。
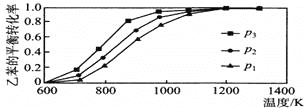
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
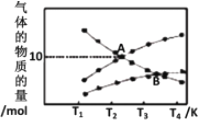
则A点时,NO2的转化率为_______________。
B点时,设容器的总压为a Pa,则平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=____________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3H2O吸收。已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2kJ/mol,中和热ΔH=-57.3kJ/mol则1molNH3H2O理论上完全电离时需要吸收的热量为___。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为47之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式___。
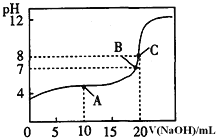
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4molSO2,发生SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=-41.8kJ/mol在不同温度下测定同一时刻NO2的转化率,结果如图所示。
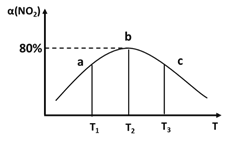
①a、c两点反应速率大小关系:v正(a)___v逆(c)。(填“>”“<”或“=”)
②温度为T2时,该反应的平衡常数为___。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率___(填“增大”“减小”或“不变”)。