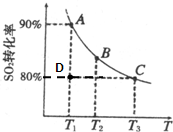
题目内容
20.如图所示的是氢氧燃料电池原理示意图,电解质溶液为中性,按照此图的提示,下列叙述不正确的是( )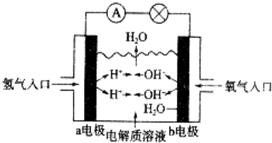
| A. | a电极为负极 | |
| B. | b电极的电极反应式为4OH-→2H2O+O2↑+4e- | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将氧化剂和还原剂全部储藏在电池内的新型发电装置 |
分析 氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,通入氧气的一极为原电池的正极,电子由负极经外电路流向正极,负极反应式为H2-2e-=2H+、正极反应式为O2+2H2O+4e-=4OH-,据此分析解答.
解答 解:A.氢氧燃料电池中,通入氢气的a极为电源的负极,通入氧气的b极为原电池的正极,故A正确;
B、氢氧燃料电池中,通入氧气的b极为原电池的正极,该极上发生得电子的还原反应:O2+4e-+2H2O═4OH-,故B错误;
C、氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,故C正确;
D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
10.下列有关化学实验操作正确的是( )
| A. |  闻气味 | B. | 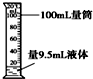 量取液体 | ||
| C. | 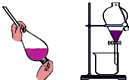 将乙醇与水分离 | D. |  检查装置的气密性 |
11.X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M.下列叙述正确的是( )
| A. | M的单质具有两性,所以能与NaOH溶液发生反应生成氢气 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
15.黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对该黄铁矿石进行如下实验探究.将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.

其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
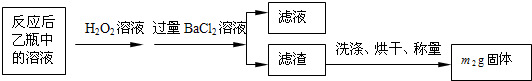
(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O(用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣→②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤→③将滤液稀释至250mL→④取25.00mL稀释液用0.1 000mol/L的酸性KMnO4溶液滴定
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=0.5000mol/L.

其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O(用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣→②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤→③将滤液稀释至250mL→④取25.00mL稀释液用0.1 000mol/L的酸性KMnO4溶液滴定
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
12.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1mol甲基(-CH3)含有9NA个电子 | |
| B. | 标准状况下,22.4LSO3含有的原子数为4NA | |
| C. | 0.10mol•L-1NaOH溶液中含有OH1离子数是0.1NA | |
| D. | 5.6Fe与2.24LCl2充分反应转移电子数为0.2NA |
9.科学家最新开发的一种新原理二次电池的能量密度是现行锂电池的7倍,该电池结构如图所示,下列有关说法正确的是( )


| A. | 电池放电时Li+向负极移动 | |
| B. | 电池放电时,正极的电极反应式为:2Li++Li2O2+2e-═2Li2O | |
| C. | 电池充电时,Li极应与外电源的正极相连 | |
| D. | 电池系统内进入二氧化碳及水对电池性能不会产生影响 |
10.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol.L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 22.4LCl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA | |
| C. | 室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol-OH与1 molOH-所含电子数均为9 NA |