题目内容
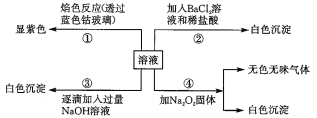
【题目】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物, B溶于水得蓝色溶液,E为红棕色粉末,它们有如下图所示的关系(反应中生成的水已略去)。

试回答下列问题。
(1)推断填写物质化学式:A是________ ,D是_________,E是_________,H是_________。
(2)F的类别是_________(选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应④的化学方程式为___________________________________________。
【答案】 Cu AlCl3 Fe2O3 FeCl3 两性氧化物 2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
【解析】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物,B溶于水得蓝色溶液,所以A是铜,与氯气反应生成B是氯化铜。E为红棕色粉末,E是氧化铁C与氧化铁反应生成G和F,则根据反应条件高温可判断反应④是铝热反应,所以C是Al,G是铁,F是氧化铝,与盐酸反应生成D是氯化铝,铝与氯化铜发生置换反应生成铜和氯化铝。铁UI氯气化合生成H是氯化铁,遇KSCN溶液显红色。
(1)根据以上分析可知A是Cu,D是AlCl3,E是Fe2O3,H是FeCl3。(2)氧化铝属于两性氧化物。(3)反应④的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。

 名校课堂系列答案
名校课堂系列答案【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |

(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________