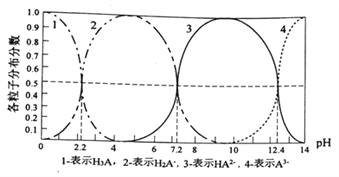
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ”–“ΜΤΩΈό…Ϊ»ή“ΚΘ§Τδ÷–Ω…ΡήΚ§”–Al3ΘΪΓΔFe2ΘΪΓΔMg2ΘΪΓΔBa2ΘΪΓΔKΘΪΓΔClΘ≠ΓΔSO42Θ≠Β»άκΉ”÷–ΒΡΦΗ÷÷Θ§ΈΣΖ÷ΈωΤδ≥…Ζ÷Θ§»Γ¥Υ»ή“ΚΖ÷±πΫχ––ΝΥΥΡΗω Β―ιΘ§Τδ≤ΌΉςΚΆ”–ΙΊœ÷œσ»γœ¬ΘΚ
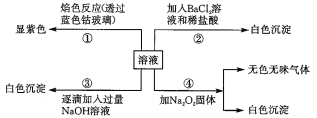
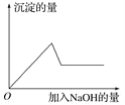
ΒΎΔέΗω Β―ι÷–Θ§…ζ≥…ΑΉ…Ϊ≥ΝΒμΒΡΝΩ”κΦ”»κNaOHΒΡΝΩ”–»γΆΦΥυ ΨΒΡœύΜΞΙΊœΒΓΘΨί¥ΥΩ…÷ΣΘΚ
(1)‘Ύ‘≠»ή“Κ÷–“ΜΕ®≤Μ¥φ‘ΎΒΡάκΉ””–______________ΘΜ≤ΜΡή»ΖΕ® «Ζώ¥φ‘ΎΒΡάκΉ””–________ΓΘ
(2)–¥≥ωΒΎΔέΗω Β―ι÷–“ά¥ΈΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ___________ΓΔ____________ΓΔ______ΓΘ
ΓΨ¥πΑΗΓΩFe2ΘΪΓΔBa2ΘΪ ClΘ≠ Mg2ΘΪΘΪ2OHΘ≠===Mg(OH)2Γΐ Al3ΘΪΘΪ3OHΘ≠===Al(OH)3Γΐ Al(OH)3ΘΪOHΘ≠===AlO2ΓΣΘΪ2H2O
ΓΨΫβΈωΓΩ
»ή“ΚΈό…ΪΘ§‘ρFe2+(«≥¬Χ…Ϊ)“ΜΕ®≤Μ¥φ‘ΎΘΜ―φ…ΪΖ¥”Πœ‘Ήœ…ΪΘ§ΥΒΟς“ΜΕ®”–K+ΘΜ Β―ιΔΎ÷–Φ”»κ―ΈΥαΥαΜ·ΒΡ¬»Μ·±Β»ή“Κ≤ζ…ζΑΉ…Ϊ≥ΝΒμΘ§ΥΒΟς“ΜΕ®”–SO42Θ≠Θ§‘ρBa2+“ΜΕ®≤Μ¥φ‘ΎΘΜ”… Β―ιΔέ“‘ΦΑΆΦœώΩ…÷ΣΦ”»κ«β―θΜ·ΡΤΚσ≤ζ…ζΑΉ…Ϊ≥ΝΒμΘ§¥οΒΫΉν¥σ÷ΒΚσ≥ΝΒμΩΣ ΦΦθ…ΌΘ§ΒΪ≤ΜΆξ»Ϊœϊ ßΘ§“ΜΕ®”–Mg2+ΓΔAl3+Θ§ΕχClΘ≠Ά®Ιΐ…œ ωΥΡΗω Β―ιΈόΖ®»ΖΕ®ΓΘΨί¥ΥΫβ¥πΓΘ
Θ®1Θ©”……œ ωΖ÷ΈωΩ…÷ΣΘ§‘Ύ‘≠»ή“Κ÷–“ΜΕ®≤Μ¥φ‘ΎΒΡάκΉ””–Fe2ΘΪΓΔBa2ΘΪΘ§“ΜΕ®¥φ‘ΎΒΡάκΉ””–Al3+ΓΔMg2+ΓΔK+ΓΔSO42Θ≠Θ§≤ΜΡή»ΖΕ® «Ζώ¥φ‘ΎΒΡάκΉ””–ClΘ≠ΘΜ
Θ®2Θ©‘Ύ‘≠»ή“Κ÷–¥φ‘ΎAl3+ΓΔMg2+άκΉ”Θ§Φ”»κΉψΝΩ«β―θΜ·ΡΤ»ή“Κ ±Θ§œ»…ζ≥…«β―θΜ·ΟΨΓΔ«β―θΜ·¬Ν≥ΝΒμΘ§ΙΐΝΩΒΡ«β―θΜ·ΡΤΡή»ήΫβ«β―θΜ·¬Ν…ζ≥…ΤΪ¬ΝΥαΡΤΘ§“ρ¥Υ»ή“Κ÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣMg2++2OH©¹ΘΫMg(OH)2ΓΐΓΔAl3++3OH©¹ΘΫAl(OH)3ΓΐΓΔAl(OH)3+OH©¹ΘΫAlO2©¹+2H2OΓΘ