题目内容
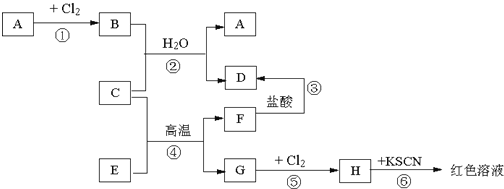
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
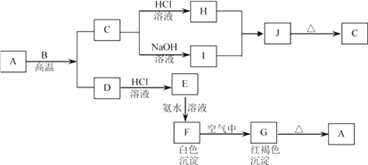
(1)写出下列物质的化学式:A:_________I:_________J:_________G:_________;
(2)按要求写出下列反应的方程式
C→I的离子方程式:_____________________________________
F→G的化学方程式:_____________________________________
(3)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
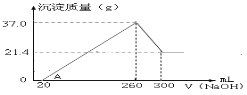
①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________;
【答案】Fe2O3 NaAlO2 Al(OH)3 Fe(OH)3 Al2O3+2OH-=2AlO2-+H2O 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 16g 6.5mol/L
【解析】
(1)A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,根据铁及化合物以及铝及化合物的有关性质来回答。
(2)根据氧化铝、氢氧化铁的性质写出相应的方程式;
(3)A和C为Fe2O3 和Al2O3的混合物,溶于100mL稀硫酸中,生成铁离子和铝离子;根据图像可知,加入氢氧化钠溶液后,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余;随着碱量的增加,沉淀逐渐增多,达到最大值,碱过量,氢氧化铝溶解,氢氧化铁不溶解,先根据溶解的氢氧化铝计算出氢氧化钠的浓度,然后再根据生成沉淀量最大时,溶液中存在的2n(Na2SO4)=n(NaOH)关系,找到n(H2SO4)= n(Na2SO4)关系,从而计算出硫酸的浓度。
A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠;
(1)根据上面的分析可以知道,则A为Fe2O3, I是NaAlO2,J是Al(OH)3,G是Fe(OH)3;
因此,本题正确答案是: Fe2O3; NaAlO2;Al(OH)3 ;Fe(OH)3。
(2) 氧化铝是两性氧化物,氧化铝在氢氧化钠溶液中反应生成偏铝酸钠和水,C→I的离子方程式:Al2O3+2OH-=2AlO2-+H2O;综上所述,本题答案是:Al2O3+2OH-=2AlO2-+H2O。
氢氧化亚铁与氧气、水共同作用生成氢氧化铁,F→G的化学方程式:4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ;综上所述,本题答案是:4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
(3) A和C为Fe2O3 和Al2O3的混合物,溶于100mL稀硫酸中,生成铁离子和铝离子;根据图像可知,加入氢氧化钠溶液后,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余;随着碱量的增加,沉淀逐渐增多,达到最大值,碱过量,氢氧化铝溶解,氢氧化铁不溶解,
①根据21.4g沉淀的质量是氢氧化铁的质量,氢氧化铁物质的量是21.4/107=0.2mol,根据铁元素守恒,所以氧化铁的物质的量是0.1mol, Fe2O3的质量是0.1×160=16g;
因此,本题正确答案是16。
②从260-300mL,NaOH溶解Al(OH)3,发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,氢氧化铝的质量是:37-21.4=15.6g,即0.2mol,消耗NaOH为0.2mol,所以氢氧化钠的浓度0.2/0.04=5mol/L;当V(NaOH)=260mL时,沉淀量最大,此时沉淀为Fe(OH)3和Al(OH)3,溶液中溶质为Na2SO4;根据钠元素守恒:2n(Na2SO4)=n(NaOH),n(Na2SO4)=0.5n(NaOH)=0.5×0.26×5=0.65mol;根据硫酸根离子守恒:n(H2SO4)= n(Na2SO4)=0.65mol,则c(H2SO4)=0.65/0.1=6.5mol/L;
综上所述,本题答案是:6.5mol/L。

 优生乐园系列答案
优生乐园系列答案