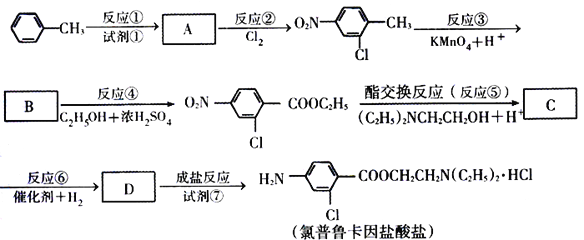
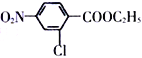
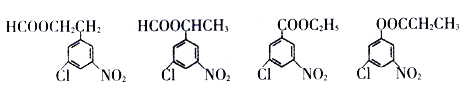
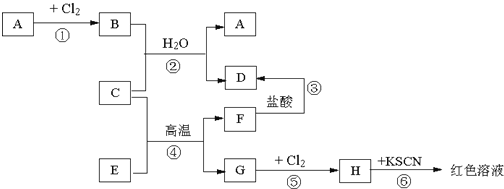
题目内容
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
(1)制备NaN3:
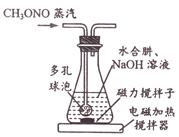
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
【答案】 增大CH3ONO与反应液的接触面积,加快反应速率 N2H4·H2O+CH3ONO+NaOH![]() NaN3+CH3OH+3H2O 蒸馏 I2+2S2O32-===2I-+S4O62- , n(I2)=
NaN3+CH3OH+3H2O 蒸馏 I2+2S2O32-===2I-+S4O62- , n(I2)=![]() =
=![]() =1.500 0×10-3 mol,过量的n(MnO4-)=
=1.500 0×10-3 mol,过量的n(MnO4-)=![]() n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=
n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=![]() ×100% =88.40%
×100% =88.40%
【解析】(1)①装置中用到多孔球泡,多孔球泡能增大CH3ONO与反应液的接触面积,加快反应速率(或使CH3ONO充分反应) ②N2H4·H2O与CH3ONO、NaOH反应生成NaN3 、CH3OH和H2O,反应的化学方程式为:N2H4·H2O+CH3ONO+NaOH![]() NaN3+CH3OH+3H2O
NaN3+CH3OH+3H2O
③可用蒸馏的方法从反应后锥形瓶中混合物回收CH3OH,因此“操作X”的名称为蒸馏。答案为:①增大CH3ONO与反应液的接触面积,加快反应速率(或使CH3ONO充分反应) ②N2H4·H2O+CH3ONO+NaOH![]() NaN3+CH3OH+3H2O③蒸馏
NaN3+CH3OH+3H2O③蒸馏
(2)由已知条件可知I2+2S2O32-===2I-+S4O62-,n(I2)=![]() =
=![]() =1.500 0×10-3 mol,过量的n(MnO4-)=
=1.500 0×10-3 mol,过量的n(MnO4-)=![]() n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO)=1.700 0×10-2 mol,w(NaN3)=
n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO)=1.700 0×10-2 mol,w(NaN3)=![]() ×100% =88.40%,答案为:I2+2S2O32-===2I-+S4O62- span>, n(I2)=
×100% =88.40%,答案为:I2+2S2O32-===2I-+S4O62- span>, n(I2)=![]() =
=![]() =1.500 0×10-3 mol,过量的n(MnO4-)=
=1.500 0×10-3 mol,过量的n(MnO4-)=![]() n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=
n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=![]() ×100% =88.40%
×100% =88.40%

 阅读快车系列答案
阅读快车系列答案