题目内容
(12分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:NaBr+H2SO4HBr+NaHSO4 ① R-OH+HBr
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
|
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是 。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d. KCl
(1)d (2)小于 醇分子可与水分子形成氢键,溴代烃分子与水分子不能形成氢键 (3)下层 (4)abc (5)c
解析:(1)布氏漏斗常用于有机化学实验中提取结晶,而溴乙烷和1-溴丁烷均属于液体,因此不需要布氏漏斗。
(2)因为醇分子和水分子之间存在氢键,从而易溶于水,但溴代烃分子与水分子间不能形成氢键,故水溶性小于相应醇的。
(3)1-溴丁烷的密度大于水的,故在下层。
(4)浓硫酸具有强氧化性能氧化溴离子而生成单质溴,同时醇在浓硫酸的存在下易脱水生成烯和醚,所以为减少副产物的生成需要稀释浓硫酸。又因为浓硫酸溶于水会放出大量的热而造成HBr的挥发,影响制备。水并不是催化剂,d不正确。
(5)NaI易被溴分子氧化生成单质碘,从而引入新的杂质;氢氧化钠容易使溴代烷发生水解反应;KCl不能除去单质溴;NaHSO3具有还原性可以将Br2还原生成Br-,从而除去单质溴,方程式为H2O+Br2+HSO3-=2Br-+SO42-+3H+。

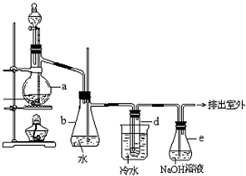 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4°C,密度为1.43g?ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4°C,密度为1.43g?ml-1;