题目内容
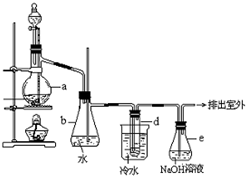 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4°C,密度为1.43g?ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4°C,密度为1.43g?ml-1;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是
(2)小火加热,在烧瓶中发生的主要反应有①NaBr+H2SO4=NaHSO4+HBr
②
(3)冷水的作用
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是
A.NaI溶液 B.NaOH溶液 C.Na2SO3溶液 D.KCl溶液
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象
(6)容器e中NaOH溶液的作用是
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂.
分析:(1)浓硫酸与蒸馏水混合过程中会放出大量热,浓硫酸密度大于水,应该先稀释浓硫酸、冷却后再加入乙醇、溴化钠;
(2)烧瓶中发生的反应有:溴化钠与硫酸反应生成硫酸氢钠和溴化氢、乙醇与溴化氢反应生成溴乙烷和水,据此写出反应的化学方程式;
(3)已知溴乙烷的沸点为38.4°C,冷水可以将溴乙烷蒸气变成液态溴乙烷;根据溴乙烷不溶于水、密度大于水进行分析;
(4)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(5)当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(6)反应剩余的溴化氢、反应副产物溴等有毒,能够污染大气,需要进行尾气吸收;
(7)加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等,据此进行解答.
(2)烧瓶中发生的反应有:溴化钠与硫酸反应生成硫酸氢钠和溴化氢、乙醇与溴化氢反应生成溴乙烷和水,据此写出反应的化学方程式;
(3)已知溴乙烷的沸点为38.4°C,冷水可以将溴乙烷蒸气变成液态溴乙烷;根据溴乙烷不溶于水、密度大于水进行分析;
(4)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(5)当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(6)反应剩余的溴化氢、反应副产物溴等有毒,能够污染大气,需要进行尾气吸收;
(7)加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等,据此进行解答.
解答:解:(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,浓硫酸密度大于水,与蒸馏水混合时会放出大量热,所以混合时应该先加入蒸馏水,再加入浓硫酸,然后加入乙醇和溴化钠,
故答案为:蒸馏水、浓硫酸、乙醇、溴化钠;
(2)根据加入的反应物可知,烧瓶中发生的反应为:①溴化钠与硫酸反应生成硫酸氢钠和溴化氢,反应的方程式为:NaBr+H2SO4=NaHSO4+HBr、②乙醇与溴化氢反应生成溴乙烷和水,反应的化学方程式为CH3CH2OH+HBr→CH3CH2Br+H2O,
故答案为:CH3CH2OH+HBr→CH3CH2Br+H2O;
(3)溴乙烷的沸点为38.4°C,通过冷水可以冷却溴乙烷,将溴乙烷由气态变成液态;由于溴乙烷不溶于水,所以冷却后混合液体会分层,溴乙烷密度大于水,在混合液的下层有油状液体,
故答案为:冷却溴乙烷由气态转变为液态;分层,下层为油状液体;
(4)A.NaI和溴单质反应,但生成的碘单质会混入,故A错误;
B.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故B错误;
C.溴单质和Na2SO3溶液发生氧化还原反应,可以除去溴单质,故C正确;
D.KCl和溴单质不反应,不能除去溴单质,故D错误;
故答案为:C;
(5)通过观察实验装置,可知b是安全瓶防止液体倒吸.锥形瓶的水中插有一直玻璃管,主要作用是检查试管c是否堵塞.当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,
故答案为:直导管中有一段水柱;
(6)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收HBr等气体,防止大气污染;
(7)A.乙醇在浓硫酸作用下反应发生消去反应生成烯烃、分子间脱水反应生成醚,稀释后减少了生成的副产物烯和醚,故A正确;
B.浓硫酸具有强氧化性,能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成,故B正确;
C.反应需要溴化氢和乙醇反应,浓硫酸溶解会使温度升高,使溴化氢挥发,稀释后减少HBr的挥发,故C正确;
D.水在制取溴乙烷的反应中为反应产物,不是该反应的催化剂,故D错误;
故答案为:ABC.
故答案为:蒸馏水、浓硫酸、乙醇、溴化钠;
(2)根据加入的反应物可知,烧瓶中发生的反应为:①溴化钠与硫酸反应生成硫酸氢钠和溴化氢,反应的方程式为:NaBr+H2SO4=NaHSO4+HBr、②乙醇与溴化氢反应生成溴乙烷和水,反应的化学方程式为CH3CH2OH+HBr→CH3CH2Br+H2O,
故答案为:CH3CH2OH+HBr→CH3CH2Br+H2O;
(3)溴乙烷的沸点为38.4°C,通过冷水可以冷却溴乙烷,将溴乙烷由气态变成液态;由于溴乙烷不溶于水,所以冷却后混合液体会分层,溴乙烷密度大于水,在混合液的下层有油状液体,
故答案为:冷却溴乙烷由气态转变为液态;分层,下层为油状液体;
(4)A.NaI和溴单质反应,但生成的碘单质会混入,故A错误;
B.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故B错误;
C.溴单质和Na2SO3溶液发生氧化还原反应,可以除去溴单质,故C正确;
D.KCl和溴单质不反应,不能除去溴单质,故D错误;
故答案为:C;
(5)通过观察实验装置,可知b是安全瓶防止液体倒吸.锥形瓶的水中插有一直玻璃管,主要作用是检查试管c是否堵塞.当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,
故答案为:直导管中有一段水柱;
(6)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收HBr等气体,防止大气污染;
(7)A.乙醇在浓硫酸作用下反应发生消去反应生成烯烃、分子间脱水反应生成醚,稀释后减少了生成的副产物烯和醚,故A正确;
B.浓硫酸具有强氧化性,能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成,故B正确;
C.反应需要溴化氢和乙醇反应,浓硫酸溶解会使温度升高,使溴化氢挥发,稀释后减少HBr的挥发,故C正确;
D.水在制取溴乙烷的反应中为反应产物,不是该反应的催化剂,故D错误;
故答案为:ABC.
点评:本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,明确物质的性质及实验原理是设计实验的前提,同时考查了学生分析问题、解决问题的能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目