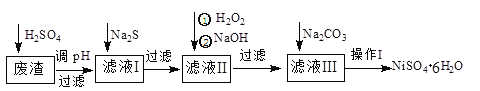
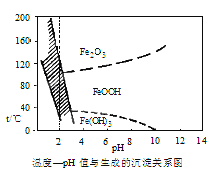
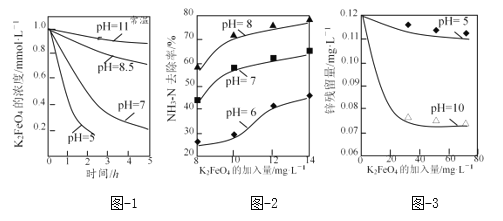
题目内容
【题目】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池B.铝合金大量用于高铁建设
C.水玻璃不燃不爆可用作耐火材料D.活性炭具有除异味和杀菌作用
【答案】D
【解析】
A. 高纯硅是半导体材料,可用于制作光感电池,故A正确;
B. 铝合金密度小、硬度大,大量用于高铁建设,故B正确;
C. 水玻璃是硅酸钠的水溶液,不燃不爆可用作耐火材料,故C正确;
D. 活性炭具有吸附性,能吸附有臭味的气体,所以活性炭除异味,但活性炭没有杀菌作用,故D错误;
选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目