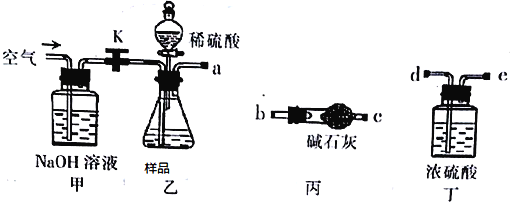
��Ŀ����
����Ŀ����������Ϣ��Ƭ��ͼ��ʾ��

(1)���ԭ������Ϊ81������Ԫ�����ڱ���λ�ڵ�________���ڣ���________�塣
(2)�����ƶ���ȷ����________��
A�����ʵĻ�ԭ�ԣ�Tl��Al
B��ԭ�Ӱ뾶��Al��Tl
C�����ԣ�Al(OH)3��Tl(OH)3
D�������ԣ�Tl3����Al3��
(3)��(Tl)��ij�������ϵ����Ԫ��֮һ��Tl3����Ag�����Խ����з�����Ӧ��Tl3����2Ag===Tl����2Ag���������ƶ���ȷ����________��
A��Tl���������1������
B��Tl���γɣ�3�ۺͣ�1�۵Ļ�����
C��Tl3���������Ա�Ag����
D��Tl���Ļ�ԭ�Ա�Agǿ
���𰸡�(1)6 ��A (2)A (3)B
��������(1)�ƶ�Tl��Ԫ�����ڱ��е�λ�ã������ø����ڵ�Ԫ��������(2��8��8��18��32)���з�����81��2��8��8��18��18��27��������֪��Ԫ��λ�ڵ�6���ڣ���6��������ϵ��15��Ԫ��ռһ������27��14��13������Ԫ�����ڱ��Ľṹ��֪����13����Ϊ�ڢ�A�壬��Tl��Ԫ�����ڱ��е�λ��Ϊ��6���ڵڢ�A�塣
(2)ͬ����������£�Ԫ�ؽ���������ǿ�����ʻ�ԭ����ǿ��ԭ�Ӱ뾶�������������Լ�����������ǿ��
(3)��λ�ڵڢ�A�壬˵����ԭ���������3�����ӣ���Tl����������������ӣ�A������Tl3����2Ag===Tl����2Ag��֪��Tl3���������Ա�Ag��ǿ��Ag�Ļ�ԭ�Ա�Tl��ǿ��C��D����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʪ����п������ͭ�������������ӵ��������£�

��֪��ͭ������Ҫ��п��ͭ�������ӣ�Cd�����ܣ�Co���ȵ��ʡ�
�±��г�����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ0.1 mol��L-1���㣩��
�������� | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.2 | 8.2 |
������ȫ��pH | 3.3 | 9.9 | 9.5 | 10.6 |
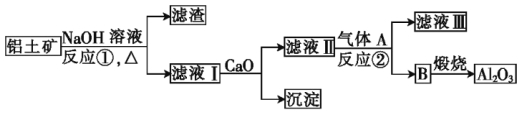
��1��Ϊ�����ͭ�������������ʣ��ɲ�ȡ�Ĵ�ʩ�У����ʵ������¶ȣ��ڽ��裻��______�ȡ���֪�����Ľ������Ӿ�Ϊ���ۣ�д�������ܵĻ�ѧ����ʽ__________________��
��2�����ܵĹ����У���Ҫ������Sb2O3��п�ۻ���Sb2O3��Co2+����Һ�γ���ز������Ͻ�CoSb������ص�������ӦʽΪ________________________________��
��3�������Ĺ��̷��������У�
���ȼ�������KMnO4��������Ӧ�����ӷ���ʽΪ______________________________��
���ټ���ZnO���Ʒ�ӦҺ��pH��ΧΪ_____________��
��4���������̵ڢٲ���������KMnO4ʱ�������Ʋ�����MnO2�������Ӧ����ɵĽ����______________���������KMnO4����������������Һ����FeԪ�ز��ࡣ�����ʵ�鷽��������֤_________________��
��5�����������Һ�ö��Ե缫���ɻ���ӵ��ʡ�����Һ�п�ѭ�����õ�������____��
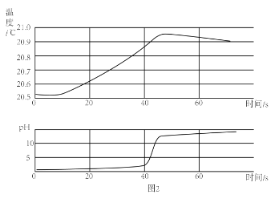
��6���������ӷ�ˮ���û�ѧ�������������Ǽ����ӵ����ܻ�������ܶȻ�������25������
Ksp(CdCO3)��5.210��12�� Ksp(CdS)��3.610��29��Ksp(Cd(OH)2)��2.010��16������������Ϣ��
����Cd2+Ч����ѵ��Լ���____________��
a��Na2CO3 b��Na2S c��CaO
��������ʯ�Ҵ������ӷ�ˮ���pHΪ11����ʱ��Һ��c(Cd2+)��_________��
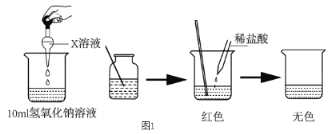
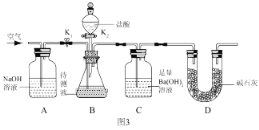
����Ŀ���Ȼ���ͭ(CuCl)�������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ҵ��������ӡˢ��·�ķ�Һ(��Fe3����Cu2����Fe2����Cl��)����CuCl��������ͼ��ʾ��
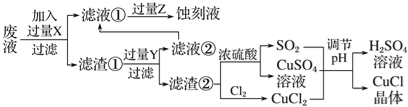
����������Ϣ�ش��������⣺
��1��д������������X________��Y________(�ѧʽ)��
��2��������CuCl���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�Ŀ����________________________�����������е�����Һ��pH���ܹ����ԭ����________________________��
��3��д������CuCl�Ļ�ѧ����ʽ��__________________________________��
��4����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��������_________________��
��5����֪��������Ksp(CuCl)=1.6��10-7��Ksp(CuI)=1.2��10-12������CuCl������Һ�м���NaI������c(I-)=0.1mol/L����ʱ��Һ��c(Cu+)/c(Cl-)=________��
��6���Ȼ���ͭ�Ķ�������
�ٳ�ȡ��Ʒ0.25 g�����ѷ���10 mL������FeCl3��Һ����ƿ�У�����ҡ����
�ڴ���Ʒ�ܽ��ˮ50 mL���ڷ�����ָʾ��2�Ρ�
��������0.10 mol��L��1���������Һ�ζ����յ㣬ͬʱ���հ�ʵ��һ�Ρ�
��֪��
CuCl��FeCl3===CuCl2��FeCl2��Fe2����Ce4��===Fe3����Ce3����
������ظ�2�β�ã�
1 | 2 | 3 | |
�հ�ʵ������������ ����Һ�����/mL | 0.75 | 0.50 | 0.80 |
0.25 g��Ʒ���������� ����Һ�����/mL | 24.65 | 25.75 | 24.90 |
�����ݴ����������CuCl�Ĵ���Ϊ_________(ƽ��ʵ�������ܳ���0.3%)��