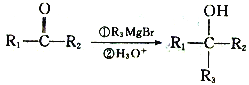题目内容
【题目】如图所示,A处通入干燥Cl2,关闭B时,C处的红色布条无明显现象,打开B,C处红色布条逐渐褪色,则D中装的是( )
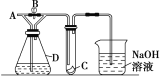
A. 浓H2SO4 B. NaOH溶液
C. 浓盐酸 D. 饱和NaCl溶液
【答案】B
【解析】
次氯酸具有漂白作用而氯气不具有漂白性,所以干燥的氯气不能漂白有色布条,含水蒸气的氯气能使有色布条褪色,A处通入氯气,关闭B阀后,C处红布逐渐褪色,说明D处可以带出水蒸气,以此来解答。
红色布条是否褪色取决于布条上是否产生了HClO。当关闭B通入干燥Cl2时,气体首先进入D中,此时,C处的红色布条无明显现象,说明无Cl2到达C处或C处布条是干燥的,打开B后,干燥的Cl2会经过B直接到C处,红色布条逐渐褪色,说明C处产生了HClO,则可说明红色布条是湿润的,经过D处的Cl2则完全被吸收了。选项中能吸收Cl2的只有NaOH溶液。答案选B。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】下列实验中,对应的现象以及结论都正确且两者相符的是( )
选项 | A | B | C | D |
实 验 |
|
|
|
|
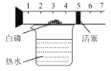
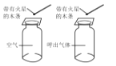
实 验 现 象 | 打开汽水瓶盖时,汽水 会自动喷出来 | 碘溶于水,几乎不溶于 汽油 | 白磷燃烧,产生大量白烟,活塞先向右再向左移,冷却至室温后,最终停在刻度“4”附近 | 空气中,带火星的木条复燃;呼出气体中,带火星的木条熄灭 |
实 验 结 论 | 说明气体在水中的溶解度随压强的增大而减小 | 说明物质的溶解性与溶剂的种类有关 | 氧气约占空气体积的五分之一 | 空气中的氧气比呼出气体中氧气多 |
A. A B. B C. C D. D
【题目】碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态碳原子核外电子有__种空间运动状态,其价电子排布图为__.
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为__,其碳原子杂化轨道类型为_____杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?。 ______________
(4)碳的一种同素异形体﹣﹣C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:![]() 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。

(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为__个.已知石墨的密度为ρg·cm﹣3,C﹣C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__cm.
(6)金刚石和石墨的物理性质差异很大,其中:熔点较高的是___________,试从结构分析___________;硬度大的是___________,其结构原因是___________。