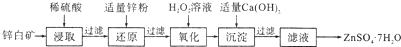
题目内容
16.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据同周期元素的电负性变化趋势,推出Ar的电负性比Cl大 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
分析 A.Mg的3s全满,为稳定结构;
B.F没有正价;
C.Ar为稀有气体,性质稳定;
D.CO2通入NaClO溶液中,发生强酸制取弱酸的反应.
解答 解:A.同周期元素的第一电离能从左向右增大,而Mg的3s全满,为稳定结构,则Al的第一电离能比Mg小,故A错误;
B.主族元素最高正化合价与族序数的关系,而卤族元素中除F外最高正价都是+7,故B错误;
C.同周期元素的电负性从左向右增大,而Ar的电负性比Cl小,Cl易得到电子,可知同周期中卤素原子的电负性最大,故C错误;
D.CO2通入NaClO溶液中,发生强酸制取弱酸的反应,规律合理,故D正确;
故选D.
点评 本题考查较综合,涉及元素周期律、物质结构与性质,为高频考点,把握电负性、电离能的比较方法及元素的性质、酸性比较为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7. 乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )
乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )
 乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )
乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )| A. | 与HCl加成生成CH3COCl | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3OH加成生成CH3COCH2OH | D. | 与CH3COOH加成生成(CH3CO)2O |
4.下列分离与提纯物质的实验操作中错误的是( )
| A. | 萃取时,要求萃取剂的密度比水的密度大 | |
| B. | 蒸馏时,温度计水银球与蒸馏烧瓶支管口相平 | |
| C. | 过滤时,要将待过滤混合物转移到漏斗中 | |
| D. | 分液时,分液漏斗的下口必须紧贴在烧杯壁上 |
11.下列关于元素周期表的叙述,正确的是( )
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 元素周期表共有16个族,也就是16个纵行 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
1.锶(Sr)位于第五周期第ⅡA族,下来关于锶及其化合物的性质推断错误的是( )
| A. | Sr能与水反应,生成氢气 | |
| B. | Sr(OH)2具有两性 | |
| C. | SrSO4在水中溶解度很小 | |
| D. | SrCl2溶液和Na2CO3溶液能发生反应 |
8.某短周期元素最外层上只有2个电子,该元素( )
| A. | 一定是金属元素 | |
| B. | 一定是ⅡA族元素 | |
| C. | 一定是非金属元素 | |
| D. | 可能是金属元素也可能是非金属元素 |
5. Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,温度越高反应速率越快.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
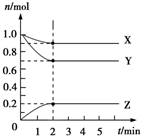
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
 Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
6.甲烷的燃料电池,稀硫酸作电解质溶液,下列说法正确的是( )
| A. | 燃料电池工作时O2在正极上发生氧化反应 | |
| B. | 燃料电池在工作时需要点燃甲烷 | |
| C. | 燃料电池工作时燃料在负极上发生氧化反应 | |
| D. | 燃料电池工作时负极的电极反应式为:2H2O+O2+4e-=4OH- |